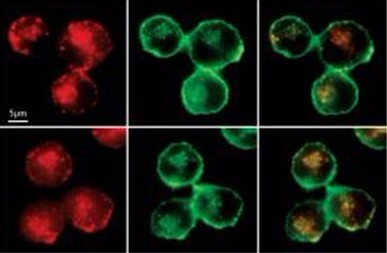
相比于未处理的树突细胞(顶端),用HSP90抑制物根赤壳菌素(radicicol)(底部)处理过的树突细胞倾向于在膜包被的胞内体(绿色;中间)中保留较高水平的抗原卵清蛋白(红色;左边)。胞内体用标记膜蛋白PKH67的染色剂标记。图片来自美国国家科学院。
当身体自己的细胞变成滴答作响的定时炸弹时,就像发生病毒感染或癌变时那样,一种称作“交叉呈递(cross-presentation)”的机制使得免疫系统的树突细胞(dendritic cells, DCs)发出警报。
来自日本横滨市理化研究所过敏症和免疫学中心(RIKEN Center for Allergy and Immunology)的Heiichiro Udono解释道,“树突细胞首先通过吞噬作用(phagocytosis)内化癌变或病毒感染的细胞,然后将细胞抗原加工为短肽。”树突细胞随后将这些短肽片段呈递给杀伤性T细胞(killer T cell),然后杀伤性T细胞找出和破坏其他的受影响细胞。吞噬分子在称作胞内体(endosome, 译者注也常译作内体)的封闭性膜泡内移动。Udono和他的同事们开展的一项新研究为揭示交叉呈递之前这些抗原如何被释放到细胞质提供新的启示。
Udono研究小组集中研究热休克蛋白90(heat-shock protein 90, HSP90),而且以前研究将这种分子与交叉呈递相关联起来。HSP90存在两种形式:α和β,它们的作用存在重叠。小鼠至少需要这些蛋白的一种才能存活。Udono和同事们成功地产生唯一缺乏HSP90α的健康小鼠。他们发现,尽管HSP90β似乎起着一定作用,但是缺乏HSP90α在抗原加工上有着显著性影响。从这些小鼠中分离出的树突细胞在交叉呈递方面存在缺陷,在接触模式抗原卵清蛋白之后不能有效地激活杀伤性T细胞。
缺乏HSP90α的树突细胞能够完美地内化卵清蛋白到胞内体,然而他们一般不能释放这种抗原到细胞质。在用抑制HSP90α的化学物处理遗传上正常的树突细胞后,研究人员观察到类似的结果,从而证实这种蛋白在胞内体释放上起着核心作用。
Udono和同事们通过将细胞色素c---一种被摄取和释放到细胞质后选择性消除树突细胞亚群的蛋白---注射进缺乏HSP90α的小鼠进一步证实这些缺陷的程度。引人注目的是,相对于野生型树突细胞,细胞色素c处理显著性地降低对来自缺陷小鼠的树突细胞的影响。
Udono说,“这是一种最为灵敏的展现抗原运输到细胞质的体内检测方法。在HSP90α敲除的小鼠中,这种现象并不存在,这使得我充满自信:我们的发现比较重要和有着重大生理影响。”
相应地,Udono相信调节HSP90活性的分子可能有助于临床医生提高病人免疫反击感染或癌症的能力。他说,“如果我们能够控制HSP90和其他热休克蛋白的表达水平,它可能对人类健康有着重大好处。” (生物谷:towersimper编译)
新闻来源:http://www.bioon.com/biology/Immunology/516500.shtml



















留言