在基因组编辑过程中,人们利用Cas9这一酶来切割选定的DNA序列,但是它也能在脱靶位点造成这种缺口(指除了目标位点之外的其他相似位点也能进行切割)。现在利用蛋白质工程,科学家得到了几乎没有脱靶效应的Cas9酶。
在过去的30000年里,人们通过选育的方法在保留了狼的一些基因同时消除了一些其他的基因,这在遗传学上改变了狼,从而产生了狗。现在,有两项研究(一项载于本期490页[1],另一项载于《科学》(Science)杂志[2])应用基因工程的手段驯化了另一种意义上的“野生动物”——一种叫做Cas9的核酸酶。通过他们的研究,研究人员显著降低了这种酶不讨人喜欢的本性,同时保留了其可由RNA引导来切割DNA的能力。这一“分子驯化”的壮举对于从事基因组编辑(所谓基因组编辑是指在一个细胞或者一个生物体中准确而有效的按照研究者的意图来改变DNA序列)的研究者来说可以说是一个天大的好消息;而这种精确的编辑要求对靶标高度专一的核酸酶[3]。
在其自然“野生”状态下,Cas9是细菌免疫系统中的一部分。当细菌被一些寄生物感染,比如病毒等,生物体内的一系列分子便会将入侵者DNA的一部分切断并且将其存贮在细菌自身基因组中一个叫做CRISPR位点[4]的地方。Cas9之后便能通过与储存在CRISPR位点中外来序列的RNA拷贝(为了简洁,这一RNA之后将被称为引导RNA,或者gRNA)结合来保护细菌不受入侵者再次威胁。这一酶比较其结合的gRNA序列和胞内的DNA序列,如果能够匹配,Cas9便切断入侵的DNA。这些进攻者通过改变它们的DNA序列来躲过Cas9,所以Cas9也通过进化使得自己能够切割与gRNA并不那么完美配对的外来DNA。
此种以及他种细菌自我保护机制的研究对基因组编辑带来了巨大的影响。在这一过程中,核酸酶在细胞内切割DNA,并且当这一DNA断裂被修复的同时,人们所期望得到的改变(DNA被破坏,修复或者在原有的DNA断裂处插入一个新的基因)就替换了原始的序列[3,4,5]。第一项基因组编辑实验利用的是另一个家族的核酸酶,锌指核酸酶[5](Zinc-fingernucleases ZFNs),但是自从发现Cas9是由gRNA来引导的,基因组编辑在研究中应用的规模和范围都得到了显著的提升[6],因为gRNA使得对这一酶的设计过程变得简单并且具有高的性价比。
进化产生的Cas9能够保护细菌,其基因组比人类基因组小1800倍,而剪切不那么完美地与gRNA互补配对的DNA序列则是一种对其“自然界战场”的适应。结果就是,当Cas9从“野外”被放到人类细胞中时,除了我们感兴趣的基因,它在我们意料之外的DNA片段上也导入基因改变[7]。想象一个近视的犯罪目击者,试着从警察的嫌疑犯名单中去确认凶手,他所依赖的不仅仅是罪犯独一无二的面部特征,同时也要参考一些基本特征比如性别或者身高。这便会导致错认身份,因为目标与目击者脑中模糊图像(面部特征)的较弱匹配可能会被一些基本特征的正确匹配所加强。相似的,野生型的Cas9不仅仅利用gRNA的序列特异性来寻找其目标,也通过结合DNA骨架,而骨架对于每个基因来说都是一样的。
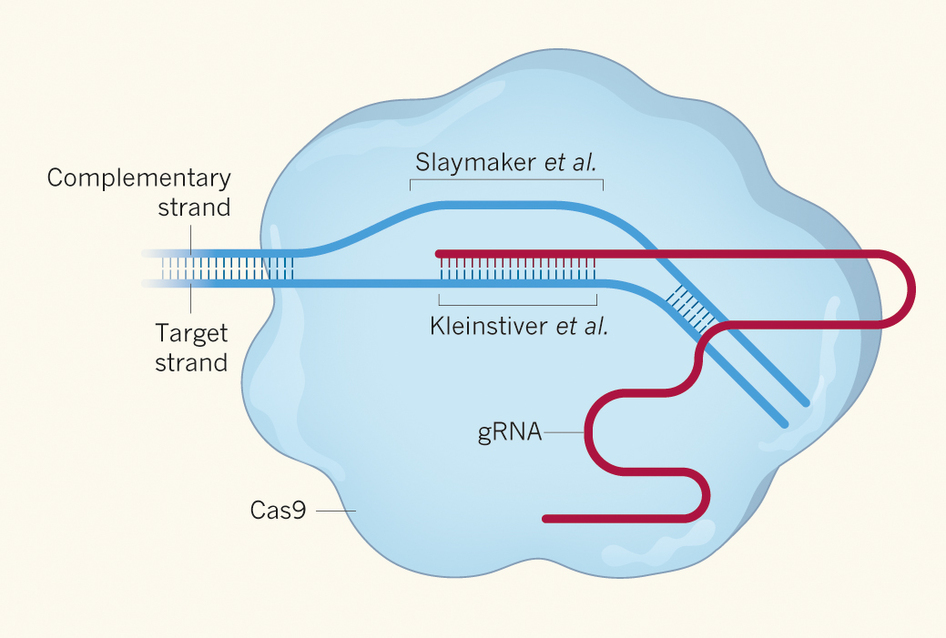
图1:驯化一种野生型酶
在这项研究中Kleinstiver等人[1]以及Slaymaker等人2希望通过一种经过深思熟虑并且利落的方法来驯化Cas9,这依赖于全面的了解这一酶是如何结合并且切割DNA的[8]。(关于锌指是如何结合DNA的研究[9]与之相关,并为第一项基因组编辑试验提供了基础。)研究团队推测,通过改造Cas9使得其与DNA骨架的结合变弱,他们可以促使该酶更大程度上依赖gRNA-DNA配对来识别并切割它的靶标(图1)。
Cas9利用gRNA与解链的DNA双螺旋中特定序列的互补配对来确定其靶标,并将其切割。Kleinstiver等[1]通过对Cas9进行改造使得其对gRNA-DNA互补双链骨架的相互作用减弱。Slaymaker等[2]则着眼于改变酶与剩下那条并不被gRNA识别的DNA单链的接触。这些改变使得改造后的酶更加依赖gRNA的序列识别,因此提高了它们的结合特异性。(改编自参考文献1)
Kleinstiver和同事们在一个癌症细胞系中测试了得到的高保真Cas9(high-fidelity Cas9,Cas9-HF)的编辑特异性。他们通过不同的gRNA让Cas9-HF来靶标七个不同的人类DNA片段:在其中六个片段中Cas9-HF都只切割了目标位置,而对剩下的片段该酶只结合了区区一个脱靶位点。相比之下,野生型的Cas9与设计的七个gRNA结合之后在多个非目标序列进行了切割。重要的是,对于测试过的75%的靶标来说,Cas9-HF能像它的“野生祖先”一样进行有效的基因组编辑。虽然在在分析和改造的细节方面与前者有所不同,Slaymaker和同事们应用相同的基本原则制造了一种叫做特异性增强Cas9(enhanced specificity Cas9 ,eCas9)的酶。
这些已经“被驯化”的Cas9肯定会被全世界的实验室应用。它的即时影响会是缩短基因组编辑实验的时间,因为用来检查非目的编辑位点的时间会大大减少。Cas9也被用于同时系统地扫描很多科学家感兴趣的人类基因[10],现在这样的实验会变得更为有效率。在农业上——特别是那些有很长生命周期的物种,比如作物或者牛——应用增强的Cas9也许能避免耗时的杂交来直接获得编辑生物体。
基因组编辑最初在2009年用于临床,当时是使用一个离体的基于ZFN的方法来编辑HIV携带者的某种免疫细胞[11]。这一方法从那以后治疗了超过80名患者,并且有着良好的安全性记录。去年12月,美国食品药品监督管理局审查通过了首例体内基因编辑临床试验,该试验利用基于ZFN的策略来治疗血友病[12]。经过改造,ZFNs早已拥有了可以与Cas9-HF相媲美的特异性(见go.nature.com/mkl6v1),并且闯过了监管部门的重重障碍被批准用于体内和离体临床试验。放眼当前的研究,人们有理由相信临床基因组编辑的应用范围会继续扩张。这一领域的进步为许多疾病发展基因治疗提供了希望,让基因治疗之路更加平坦,不再遥不可及。
参考文献
Kleinstiver, B. P. et al. Nature 529, 490–495 (2016).
Slaymaker, I. M. et al. Science 351, 84–88 (2016).
Carroll, D. Annu. Rev. Biochem. 83, 409–439 (2014).
Doudna, J. A. & Charpentier, E. Science 346, 1258096 (2014).
Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S. & Gregory, P. D. Nature Rev. Genet. 11, 636–646 (2010).
Bolukbasi, M. F., Gupta, A. & Wolfe, S. A. Nature Methods 13, 41–50 (2015).
Tsai, S. Q. et al. Nature Biotechnol. 33, 187–197 (2015).
Jiang, F. & Doudna, J. A. Curr. Opin. Struct. Biol. 30, 100–111 (2015).
Pavletich, N. P. & Pabo, C. O. Science 252, 809–817 (1991).
Shalem, O., Sanjana, N. E. & Zhang, F. Nature Rev. Genet. 16, 299–311 (2015).
Tebas, P. et al. N. Engl. J. Med. 370, 901–910 (2014).
Sharma, R. et al. Blood 126, 1777–1784 (2015).



















留言