从一到一万:基因编辑在遗传疾病治疗中的应用
2021-10-27 16:22:00随着单碱基基因编辑工具的进一步完善,它将在人类的遗传性疾病的基因治疗中发挥越来越多的作用。

生命的遗传物质是DNA。基因好比是一串由DNA碱基“字母”拼起来的词句,构成了生命的“遗传天书”。如果“字母”出错,基因就不能正常行使功能,甚至产生有害的功能,引起各种各样的疾病。而“遗传天书”中的错误,既有单个字母的“错字”,也有成千上万个“字母”的缺失。自从人类基因组计划完成以来,人类第一次完全破译了DNA的“遗传天书”,疾病的遗传学基础一一被阐明,如何修复这些疾病相关的“错误”,是科学家面临的新的挑战。
近年来基因编辑技术的发展,首次使DNA可以直接成为药物开发的靶标,修复“遗传天书”中的错误,从而根治一些疾病,尤其是单基因遗传性疾病。现在最常用的CRISPR/Cas9基因编辑技术,好比是一把可以精确控制的“剪刀”,将“剪刀”精确定位到某些区域内的基因上,同时提供正确的修复模板,用以实现突变基因的修复。然而,“剪刀”也会造成目的基因的破坏和删除,无法同时实现精确和高效修复的目的。为开发更好的基因编辑方法,近年来,科学家逐步把单一功能的CRISPR “剪刀”, 改造成多功能的“瑞士军刀”。例如,单碱基基因编辑技术,利用CRISPR的精准定位功能,招募特定的碱基修饰酶,就可以直接对单个“字母”进行修改,完成单碱基的基因编辑,治疗单个“字母”错误造成的疾病。此外,研究还发现,精确地针对某些“字母”进行置换,也可以修复上万个“字母”缺失造成的疾病。因此,这一技术有可能在人类疾病治疗中得到广泛的应用。
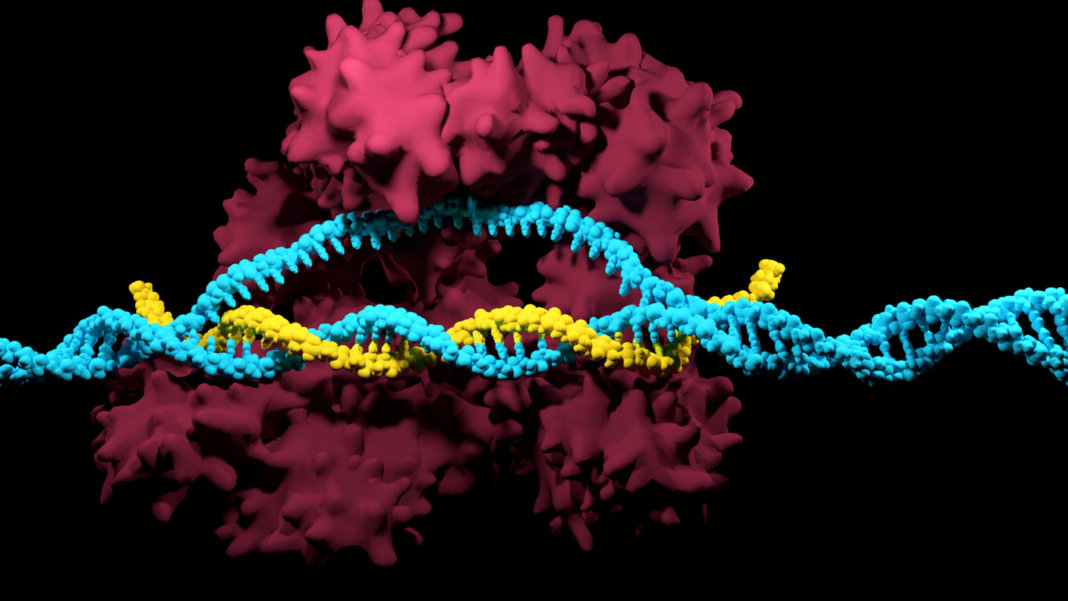
CRISPR/Cas9基因编辑技术
CRISPR/Cas系统是细菌中的适应性免疫系统, 原本是细菌用于降解噬菌体DNA的机制。经过遗传工程改造的CRISPR/Cas9系统仅包括1个Cas9 蛋白和1条向导RNA(sgRNA),在sgRNA的定位下, Cas9蛋白可以像剪刀一样, 对靶向DNA进行切割。利用CRISPR/Cas进行基因编辑,只需提供20 个碱基对的特异性核酸序列,因此,其构建过程相对之前的基因操作技术更加简单、快捷,适合规模化、高通量的组装,操作简单,制作成本低,受到越来越广泛的应用。尽管具有很多优势,但常用的CRISPR/Cas系统也存在一些缺点。
首先,利用CRISPR/Cas9技术进行修复突变的效率较低。CRISPR/Cas9主要采用同源重组的方式,同源重组主要发生在细胞分裂的DNA复制前期和复制期,因此在不分裂的体细胞中,同源重组基本上无法实现。此外,基于CRISPR的基因编辑依赖于对DNA双链的切割,而DNA断裂造成的损伤可能造成哺乳动物细胞癌变;在一些细胞中,DNA断裂可造成细胞死亡,使依赖于CRISPR酶切活性的基因编辑无法实现。
其次,CRISPR/Cas9不仅靶向编辑目标DNA位点,而且会切割那些与靶位点序列相同(或高度相似) 的其他DNA位点,使其产生突变,即脱靶效应。脱靶效应是CRISPR/Cas9基因编辑技术所面临的最主要问题。由于Cas9蛋白对sgRNA序列与靶位点间的错配不完全敏感,其脱靶风险较高。
基于以上原因,现在的CRISPR/Cas9技术应用大多针对细胞系或体外培养的干细胞,或者对模式生物进行基因编辑,对于大部分的体细胞只能进行基因敲除,无法精确地进行基因修复。现阶段利用CRISPR基因编辑技术开展疾病治疗,也主要是利用非同源末端连接的修复模式。
基于靶向性胞嘧啶脱氨酶的单碱基基因编辑技术
在哺乳动物细胞内,大部分细胞的同源重组效率很低,这决定了现在的CRISPR技术只能进行有效的“删除”,无法对DNA序列进行高效的“替换”。但是,在免疫系统中有一个高效的DNA突变体系,也就是抗体蛋白的亲和力成熟过程。免疫球蛋白进行高频突变,对编码的DNA序列进行随机“替换”,获得高亲和力的抗体。研究发现,这一过程主要由一个胞嘧啶脱氨酶(AID)介导。通过高频突变,抗体分子的氨基酸序列发生随机改变,经过正向选择使含有高亲和力抗体的B细胞选择性扩增,对此过程进行迭代,最终演化出高亲和力的抗体。
基于AID可以进行高效的诱导突变,将DNA序列进行“替换”,提示我们可以将这一特点和CRISPR相结合。我们发现,将dCas9和AID融合,可以利用dCas9的靶向功能,把AID蛋白招募至细胞内源的DNA上,在任何感兴趣的位点诱导高频突变。我们证明dCas9-AID融合蛋白(TAM)具有多个独特的功能,包括:(1)胞嘧啶可以随机地向其他3个碱基转变;(2)dCas9-AID融合蛋白的活性只依赖于sgRNA,与AID识别的一级序列无关;(3)dCas9-AID可以同时诱导多个胞嘧啶的突变,并且这一方法不依赖于DNA切割和修复,可以大幅提高单碱基精确编辑的效率,避免了DNA的双链断裂;(4)在一种多肽抑制剂(uracil glycosylase inhibitor,UGI)存在的情况下,TAM可以诱导胞嘧啶(C)向胸腺嘧啶(T)转变,并且其活性只局限于前间隔序列(protospacer)内的特定碱基; (5)利用dCas9-AID可以有效地预测出小分子抑制剂的耐药性突变。作为遗传操作的新技术,靶向性胞嘧啶脱氨酶有着广泛的应用前景,可以为分子进化、基因治疗和在单碱基水平上分析基因调控元件等领域提供新的方法。
除了最初的胞嘧啶单碱基编辑之外,美国哈佛大学的科学家还通过蛋白人工进化,开发出了针对腺嘌呤的单碱基编辑,可以将A转化为G;麻省理工学院的科学家将靶向RNA的CRISPR蛋白Cas13a和腺嘌呤脱氨酶ADAR融合,用于在RNA上诱导A到G的突变。
很多人类疾病,都是单碱基突变造成,因此通过单碱基基因编辑,修复错误的碱基,可以直接应用于这些疾病的基因治疗。但是,现在的单碱基编辑平台仍然不够准确,往往会在临近的2~3个碱基同时造成突变,有可能会引起其他意想不到的后果。因此,对靶点的选择和治疗方案的设计,都需要认真的考量。另外,即使同一种遗传疾病,不同患者往往有不同的致病突变,有可能需要对每个患者开发特异的治疗方案,全面衡量其效率,这从经济上和成本上都面临巨大的挑战。
利用单碱基基因编辑技术修复RNA剪接缺陷
在真核细胞中,基因在转录后还受多种不同机制的调节,包括可变剪切、差异化3’聚腺苷酸化、微小RNA介导的基因沉默等。据估计,超过75%的人类基因具有一种以上的信使RNA(mRNA)剪接方式,其中大部分可以翻译为功能性蛋白质,与RNA表达的组织特异性一起,共同造成转录组的组织特异性,介导细胞的分化,赋予不同细胞截然不同的功能,是决定细胞命运的重要环节。因为RNA剪接的重要作用,mRNA剪接的异常是许多疾病的直接诱因,估计35%~50%的人类疾病是由基因剪接异常造成。
针对RNA剪接过程进行修复是很多遗传疾病的治疗靶点。现有的调控RNA剪接的方法是通过反义寡聚核苷酸(ASO)。ASO经过特殊修饰,通过互补配对结合到RNA上后,不诱导RNA的降解,而阻断相应蛋白和RNA的相互作用,调控RNA的剪接。但是,因为RNA二级结构的影响,往往需要对ASO进行大量筛选,才能获得有效的调控特定RNA剪接的ASO序列。
利用ASO调控RNA剪接,针对一些遗传疾病,最近获得了一些成功:在临床试验中,对杜氏肌肉萎缩症 (DMD)和脊髓性肌萎缩症 (SMA)都有一定的缓解作用。然而,ASO疗法也面临一些内在的挑战,例如,大部分ASO只能有效地靶向到肝脏,无法通过血脑屏障,修复神经细胞;因为ASO作用到RNA,其作用是瞬时的,需要持续给药;ASO的合成需要复杂的修饰,因此临床应用价格昂贵(约20万美元/年);更重要的是,一些ASO疗法的效果十分有限, 例如针对杜氏肌肉萎缩症的ASO只能恢复约1%的肌萎缩蛋白表达。因此,无论从科学研究还是临床应用角度,都亟须开发出新的调控RNA剪接的基因编辑方法。
绝大多数基因中内含子的剪接位点由GU-AG构成,我们发现并证明可以利用之前开发的单碱基基因编辑,将内含子剪接位点的鸟嘌呤(G)突变成腺嘌呤(A),使这一剪接位点不能被剪接体识别,从而特异性阻断外显子识别,调控内源性mRNA的剪接。通过这一策略,有望针对多种RNA剪接缺陷造成的疾病起到治疗作用。
例如,杜氏肌营养不良症是一种致命的遗传疾病,每4000名男性中就有一人患有此遗传疾病。DMD的发病机理很简单,由于遗传突变破坏了DMD基因读码框,或产生提前终止密码子,造成肌萎缩蛋白的完全缺失,引发肌肉萎缩和瘫痪,最终造成心脏或肺功能的衰竭。过去研究证明,如果通过外显子跳跃,恢复蛋白读码框以产生内部截短的Dystrophin蛋白,可以用来治疗DMD。在我们前期的研究中,建立了DMD患者来源的诱导型多能干细胞。这个患者因为DNA大片段的缺失,超过1万个碱基的缺失,造成了DMD基因的移码突变和肌萎缩蛋白的完全缺失。我们通过设计基因编辑策略,在剪接位点精确地诱导了鸟嘌呤到腺嘌呤的突变,造成相应外显子的跳读,恢复了mRNA的读码框和肌萎缩蛋白的表达。进一步在体外分化的心肌细胞中证明心肌细胞的缺陷被完全修复。更重要的是,通过全基因组测序,只发现了一个脱靶位点,其位于基因间区域,对周围的基因编码和表达都没有影响。除此之外,我们还证明类似的策略可以用于多种RNA剪接疾病的治疗。
单碱基基因编辑的应用,现在还处于起始阶段,随着对这一工具的进一步完善,它将在人类的遗传性疾病的基因治疗当中发挥越来越多的作用。
常兴,中国科学院上海生命科学研究院研究员。
本文来自《张江科技评论》












 京公网安备11010502039775号
京公网安备11010502039775号





