细胞通过分裂而增殖。其中,有丝分裂负责遗传物质染色体的均等分离,以保证遗传稳定性,避免细胞病变或死亡。有丝分裂中,由纺锤体两极发出的微管分别捕获、牵拉染色体并最终将其排列到纺锤体中间的位置,即赤道板上(有丝分裂中期)。一种被称为纺锤体检查点的机制负责感知和监测染色体的排列状态。当所有染色体都完成排列后,纺锤体检查点会失活,并导致染色体分离,即有丝分裂后期的启动。通常认为微管与染色体的结合情况是纺锤体检查点激活与失活的关键原因,但事实上细胞到达中期后还要停留十几分钟才启动染色体分离,提示还存在其它影响因素。近来有研究提示,染色体周围形成的RanGTP很可能参与监测染色体的整体排列状态,从而作为一种双保险机制进一步确保纺锤体检查点在染色体排列完成之后才失活。但是,其中的分子机理却不清楚。
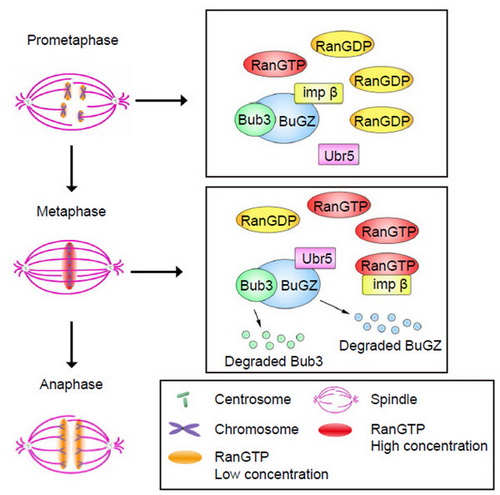
朱学良与郑诣先共同指导的博士后姜昊及其科研伙伴曾发现锌指蛋白BuGZ能以结合并稳定纺锤体检查点蛋白Bub3并促进微管与染色体的稳定连接等方式促进有丝分裂的高效性和精确性(Developmental Cell, 2014),最近又发现BuGZ可以通过相变促进纺锤体基质和纺锤体的组装(Cell, 2015)。在利用哺乳动物细胞和非洲爪蟾卵提取物等研究系统深入探讨BuGZ稳定Bub3的分子机理时,他们发现在中期时Ubr5能促使BuGZ降解,并导致Bub3降解,从而促进纺锤体检查点的失活。更重要的是,Importin-b能够与Ubr5竞争结合BuGZ,而RanGTP能与BuGZ竞争结合importin-b,并增强BuGZ和Bub3的降解。由于已知中期时染色体周围的RanGTP浓度最高,他们的结果提示此时RanGTP能够最大化地去除与BuGZ结合的importin-b,使Ubr5能攻击BuGZ并使得纺锤体检查点最终失活,染色体分离启动。他们的研究揭示了RanGTP通过染色体的整体排列状态调控纺锤体检查点活性和染色体分离的分子机理。该项研究得到国家自然科学基金委、科技部、中科院和美国NIH的经费支持。
RanGTP通过Ubr5调控BuGZ-Bub3的蛋白质水平,促进有丝分裂中期向后期转化的示意图。
新闻来源:http://www.cas.cn/syky/201510/t20151008_4434363.shtml



















留言