对参与运动控制的脑区给予电流刺激,这一方法已被成功运用到许多帕金森病患者的治疗当中。这种被称为深部脑刺激的治疗方法需要将电极植入到患者脑中——这是一个对患者有一定风险的复杂手术。
现在,来自麻省理工学院的研究人员与贝斯以色列女执事医疗中心(Beth Israel Deaconess Medical Center,BIDMC)以及信息技术研究协会基金会(ITIS基金)一道,提出一种使用放在头皮上的电极刺激大脑深层脑区的方法。这种方法可以使深层脑刺激疗法变得无创,风险更低,成本更低,更适合患者使用。
“传统的深层脑刺激疗法需要打开颅骨,植入电极,这可能会引起并发症。此外,只有少数人可以做这种神经外科手术”,麻省理工学院生物工程与脑和认知科学部门的副教授,本研究的资深作者艾德·鲍登(Ed Boyden)这样对记者表示说。本研究已经发表在6月1日《细胞》(Cell)期刊上。
医生正在利用深层脑刺激疗法治疗部分强迫症、癫痫和抑郁症患者,并在探索使用这种疗法来治疗其他疾病的可能性,比如自闭症。研究人员表示,新的非侵入性疗法可 以使深层脑刺激更适宜治疗其他疾病。本文的第一作者,现工作于美国麻省理工大学和BIDMC,前惠康信托-麻省理工学院的博士后,尼尔·格罗斯曼(Nir Grossman)表示:“借助非侵入性大脑结构刺激的能力,我们希望帮助发现治疗脑部疾病的新目标。”
深处结构
用于治疗帕金森综合征的电极通常被植入到下丘脑核内,这是一个位于丘脑下方的透镜状结构,埋在大脑深处。对于很多帕金森病患者来讲,在这个脑区传递电脉冲可以改善患者的症状,但植入电极的手术会带来包括脑出血和感染在内的风险。
其他研究人员尝试使用已经被FDA批准、用于治疗抑郁症的经颅磁刺激(TMS)等技术无创刺激大脑。由于TMS是非侵入性疗法,它也被用于正常人类受试者,来进行认知、情感、感觉和运动等方面基本科学的研究。然而,利用TMS进行大脑深层结构刺激可能会同时造成浅层脑区的强烈刺激,导致多个脑部局域网络被同时影响调制。
麻省理工学院的团队利用被称为时间干扰(temporal interference)的现象,通过放置在头皮上的电极向大脑深处传递电刺激。
这种策略需要放置在大脑外的电极产生两股高频电流。这些电流电场速度太快,无法直接进行神经元的驱动,然而,两股电流彼此干扰,在脑部深层区域交互,从而在神经元内部产生一小股低频电流。这种低频电流可以驱动神经元的电活动,而高频电流则能毫无影响地通过周围的组织。
通过调整这些电流的频率,改变电极的数量和位置,研究人员可以控制接收到低频刺激的脑组织的大小和位置。他们可以瞄准大脑深层任意位置,而不影响其他周围的脑组织结构。他们也可以通过仅仅改变电流自身来引导受到刺激的位置,而不需要移动电极。这种刺激大脑深层目标的方法可用于治疗用途,也可用于基础科学研究。
麻省理工学院媒体实验室和麦戈文(McGovern)脑研究所的成员博伊登(Boyden)说:“你可以避开表层覆盖的神经元,到达深层目标,不过空间分辨率不如(传统)的深层脑刺激。”
未参与本研究的牛津大学神经外科教授蒂普·阿齐兹(Tipu Aziz)这样评论道:“理论上只需要两股电流,就可以改变作用点,这实在是太美妙了。我看到了这种技术使得非侵入性深部脑刺激成为便携疗法在未来的可能性。如果不单单是在小鼠身上,在大型模型动物身上也能发挥作用,那我将会更加乐观。”
定点刺激
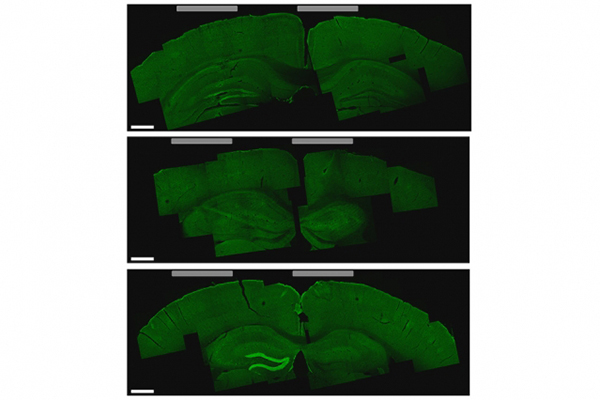
麻省理工学院皮考尔(Picower)学习与记忆研究所所长蔡惠辉(Li-Huei Tsai)及其实验室的研究人员在小鼠身上测试了这种技术,发现可以刺激包括海马体在内大脑深层的小区域。他们也能改变受到刺激的区域,使其能激活运动皮质的不同区域,控制小鼠移动四肢,耳朵或胡须。
“已经证实,我们能非常精确地定位某一大脑区域,不仅能引发激活神经元,而且能激活对应的行为反应,”本文的作者蔡先生说,“我认为这是非常令人兴奋的,因为帕金森病和其他运动障碍似乎源自大脑某一特定脑区,如果你能瞄准并作用到这个区域,你就有可能进行治疗。”
尤为显著的是,在海马体实验当中,该技术没有激活大脑皮层中的神经元,而这一区域就位于颅骨电极和脑内目标之间。研究人员还发现,没有任何大脑部位受到了有害影响。
去年,蔡证实使用光线可视性诱导特定频率的脑电波可以大大减小老鼠脑中的β淀粉样斑块,这种蛋白块会在阿尔茨海默病中出现。她现在计划研究这种电刺激能否提供一种产生相同类型有益脑电波的新方法。
以下为致谢等非重要内容:
本文的其他作者包括麻省理工学院研究科学家David Bono;前麻省理工学院博士后Suhasa Kodandaramaiah和Andrii Rudenko;麻省理工学院博士后Nina Dedic;麻省理工学院毕业生何俊洙贝斯以色列女执事医疗中心和哈佛医学院教授Alvaro Pascual-Leone;和苏黎世苏黎世研究员Antonino Cassara,Esra Neufeld和Niels Kuster。
该研究由惠康信托,美国国家卫生研究院院长先驱奖,NIH主任变革研究奖,纽约干细胞基金会罗伯森研究员奖,麻省理工学院脑,心灵和机器中心,杰里米和乔伊斯韦特海默,谷歌,国家科学基金会职业奖,麻省理工学院综合智能项目以及哈佛催化剂(Harvard Catalyst):哈佛临床和转化科学中心提供部分资金援助。
作者:Anne Trafton
















 京公网安备11010502039775号
京公网安备11010502039775号





