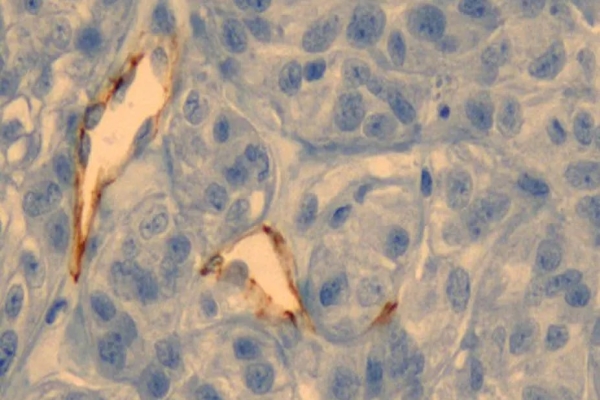
用光学显微镜观察到的肿瘤剖面。两片白色区域的棕色边界是血管组织。而金纳米颗粒就堆积在血管壁上。
金具有非凡的特性。我们可以用它来打造首饰,也可以用它来抗击癌症。利用金纳米颗粒进行治疗的临床试验正在美国如火如荼地开展。
天然状态下的金是一种黄色、具有化学惰性、极耐腐蚀的金属,这些特性让其成为一种永不衰退的高贵物质。加上其极强的可塑性,更使其成为珠宝商们的挚爱。
在纳米(一米的百万分之一)尺度上,金还具有其他一些特殊的特性。在这一尺度上,金纳米颗粒根据其形状与大小的不同而呈现不同的颜色。这一特性也曾在古时被用于给玻璃和陶器上色,比如强烈的红宝石色调。当光线照射在金纳米颗粒上时,金属的导电电子被光波激发并产生震荡。这种震荡会产生某种特定强度的光谱,我们称之为共振。
通过改变纳米颗粒的形状和大小,就有可能得到具有最强相互作用的共振频率。这时的纳米颗粒就像一个小型高效的天线,虽然它们非常小而且被高度稀释,但是依然可以给玻璃提供丰富的色彩。
这种与光的强相互作用会带来的副作用就是纳米颗粒的加热效应。不过我们正是希望利用金的这一特性来开发全新的癌症治疗方法。具体来说就是利用光热能来摧毁肿瘤,换句话说,通过光照的方式在局部对修饰肿瘤的金纳米颗粒进行加热。
接受此治疗方法的患者,需首先通过静脉注射的方式把金纳米颗粒注入血流中。根据我们在老鼠身上的研究结果,我们认为由于金具有生物相容性,所以治疗浓度下不会对健康造成危害。然而,这一新的应用方法还存在许多问题亟待解决。金纳米颗粒无法被自身免疫防御系统所识别。纳米尺度意味着他们比细胞小一百倍,这使得它们能毫无阻挡的通过血流进入到肿瘤之中。
我们的目的是让金纳米颗粒在肿瘤局部聚集。许多肿瘤的高度血管化让肿瘤得到了其赖以生存的血管网络,利用血管网络这一途径恰好也可以使纳米颗粒相对容易的在肿瘤内部聚集。肿瘤区域内血管组织多变的结构具有良好的渗透性,同样促进了纳米颗粒在肿瘤局部的高度存留。
接着用光照射被金纳米颗粒修饰的肿瘤,使其被加热并破坏。在这一阶段,挑战是双重的。首先,纳米颗粒必须在共振频率下被激发;其次,未被纳米颗粒修饰的组织不吸收光线同样很重要。当光线穿过身体抵达肿瘤时,不能让健康组织加热受损,因此对光照频率的选择至关重要。
虽然我们的身体会吸收光谱中的可见光部分(即彩虹中的所有颜色),但是在近红外线的情况下却不一定。我们可以简单的通过将手覆盖在强烈的白光上发现这一点。只有在光谱上处于近红外边缘的红色光可以透过手掌。
近红外部分的光谱范围我们通常称之为“治疗窗”-可被用于医疗治疗的范围。在可见光谱中,大部分光线主要被血红素吸收,而更接近近红外部分的光线则被我们身体内所含的水分所吸收。
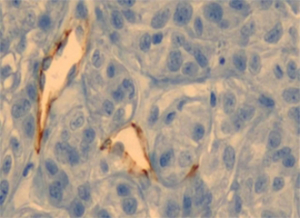
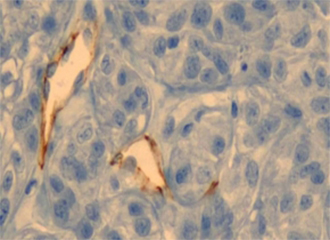
将金纳米颗粒注射到患有肿瘤的小鼠体内,五小时后光镜下的组织切片图。我们可以看到金纳米颗粒。
特殊形状的纳米颗粒
通过改变纳米颗粒的形状,可以将共振频率调节到近红外治疗窗以内的目标频率。这一特性可以在金纳米棒的具有硅核与金壳的纳米颗粒中或者形似镂空立方体的纳米笼中发挥效应。临床前研究(动物研究)让我们能在不同形状下测试纳米颗粒的安全性和有效性。
在治疗光谱中,光线穿透我们的身体,但是我们的身体也并非完全透明。从身体另一侧出来的光线仍旧会因组织的影响而高度扩散。因此,我们无法通过这种方式像X射线一样看到骨头。同样,也很难将光线从体外汇聚到肿瘤上,因为这些光必须穿过健康组织后才能抵达肿瘤组织。
因此,(在动物研究中)更为常见的做法是将一根缚有光纤的针穿过皮肤插入到肿瘤组织附近,然后通过光纤在肿瘤附近激发近红外激光。这样在相关区域的光线强度就会更高。
头颈部癌症的相关研究正在进行中
在光照下,通过加热金纳米颗粒可以“烹调”肿瘤,从而破坏附近的肿瘤细胞。例如,针对脑、前列腺、胰腺等处的癌症动物模型研究也在广泛开展。美国也正在对耐药的头颈癌、肺癌、前列腺癌患者开展AuroLase 疗法 (Nanospectra Bioscience)的临床研究。
除此之外,纳米粒子不仅可以被用作直接抗击肿瘤的武器,还可作为载体将药物转运到目的地。这项技术对加热性能的要求更低,并且载体的使用可以通过增强靶向性来减少治疗的毒性。
特洛伊木马策略
我们可以通过增加进入肿瘤的金纳米颗粒数量的方式,获得比单纯被动积累更好的效果。当这些金纳米颗粒被某些特殊分子(如抗体)包裹时,效果也会更好,因为这样它们就可通过识别细胞表面特定蛋白而靶向定位。还有一种替代技术采用了特洛伊木马策略。这种策略利用了一种称为巨噬细胞的白细胞,利用金纳米颗粒将巨噬细胞覆盖,使其更加深入到肿瘤组织当中。
金纳米颗粒光热疗法是一种治疗癌症的全新方法,这一方法前景光明,并且已经针对某些特定癌症开始了临床实验,但是在其得到广泛应用以前,依然需要更多的研究支撑。在未来,这项技术将会更高效更准确的靶向肿瘤。随着研究的蓬勃发展,这一疗法将在几年之内,如同现有的放化疗技术一般,实现可行性推广。
原文作者:Emmanuel Fort
文章翻译:刘沙
审校:施怿
简介作者:刘沙

















 京公网安备11010502039775号
京公网安备11010502039775号





