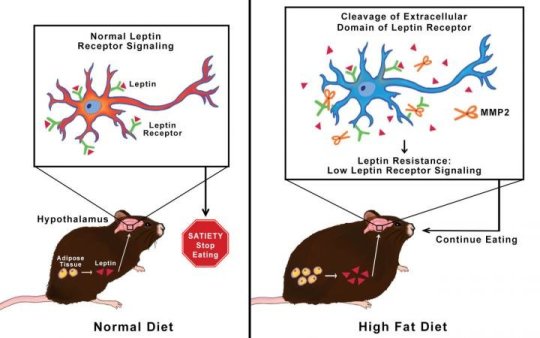
该团队发现,接受高脂饮食的小鼠可产生MMP-2酶,分解其下丘脑神经元表面的瘦素受体,阻断受体与瘦素的结合,从而无法收到饱腹信号,因而会继续进食。
这是首次在分子水平发现并描述了一种破坏机制。
研究显示,阻断MMP-2后,瘦素仍然可以与抗体结合并产生饱腹感信号。科学家希望,将来临床医生可以通过阻断MMP-2来治疗瘦素抵抗患者。他们还发现了支持这一研究成果适用范围更广的证据。
“我们开辟了一个研究代谢性疾病的新领域。”论文第一作者,加州大学圣迭戈分校生物工程学研究员Rafi Mazor说,“除瘦素和其受体之外,我们还需要探究其他具有类似破坏过程的通路,并了解其可能会引发的后果。”
Mazor所在的研究团队由来自加州大学圣迭戈分校、萨尔科生物研究所、以色列特拉维夫大学和澳大利亚莫纳什大学的研究人员组成。该团队将他们的研究成果发表在8月23日出版的Science Translational Medicine杂志上。
当其他研究着眼于阻断瘦素发挥功能的通路时,Mazor和同事们在加州大学圣迭戈分校生物工程学教授Geert Schmid-Schonbein的领导下决定探究大脑中的瘦素受体。
“我们的假设是,将蛋白质分解为氨基酸和多肽的酶可裂解膜受体,导致(配体)活性障碍。”
他和同事们正在筹备一个大规模的临床试验,以探究MMP-2抑制剂是否能够帮助人们减肥。处于肥胖早期的人体内的瘦素受体可能被裂解了,但其神经元通路完好无损,Schmid-Schonbein说。受体是可以再生的,但还不知道再生能达到什么程度。
“在阻断使受体无法进行信号传递的蛋白酶后,就可以治疗肥胖。”Schmid-Schonbein说。
在进食时,白色脂肪组织会释放瘦素分子。瘦素通过血流进入大脑,具体到达下丘脑,在这里刺激神经元受体发出饱腹感信号。肥胖者的血液中也含有高水平瘦素,但却无法产生饱腹感信号。
已知瘦素抵抗与肥胖有关,但其分子机制仍不甚明了。
研究人员首先检测了肥胖小鼠脑组织中的蛋白酶活性。正是在这一过程中他们发现了MMP-2,并猜测MMP-2破坏了瘦素受体。接着Mazor和同事们找了一个标记瘦素受体的方法以,观察受体的变化。他们观察到,MMP-2裂解了受体,使得受体失去了信号转导功能。之后,研究人员使用重组蛋白进一步证明MMP-2确实裂解了瘦素受体。他们还培养了小鼠脑细胞,发现加入MMP-2后,受体被裂解。
研究人员对一组小鼠进行了基因改造,使得它们无法产生MMP-2。即使进行高脂饮食,这组小鼠增加的体重仍然较少,瘦素受体也未受损伤。同时,给予高脂饮食而未经基因改造的小鼠出现肥胖现象,瘦素受体也被裂解。
从长远来看,研究人员希望能够设计出一种MMP-2抑制剂,或MMP-2通路活化的抑制剂。接下来的工作还包括确定人类脑细胞存在相同机制。“我们还将尝试研究蛋白酶为什么会被激活,是什么激活了这些酶,以及如何激活。”Mazor补充道。他和团队认为,其他膜受体也可能因相同的方式被损伤。“要想更好地了解高脂饮食时受体裂解,细胞功能的缺失等还需做很多工作。”
进行高脂饮食的小鼠体内会产生一种叫做MMP-2的酶,可分解其下丘脑神经元表面的瘦素受体,阻断瘦素与受体的结合,从而使神经元无法得到已经吃饱的信号,也就不会停止进食。
翻译:谢梦莹
审校:董子晨曦
















 京公网安备11010502039775号
京公网安备11010502039775号





