
干细胞(图片来源:Fabio)
Helene诊所位于东京最前卫的时尚区,楼下是一家价格昂贵的法式蛋糕店,旁边还有一些美甲沙龙和珠宝店。诊所内,医生正在为患者注射用于治疗心血管疾病的干细胞。一些穿着考究、打着领结的导医来回走动,把中国的医疗游客领到诊所的检查室。
在诊所的一项典型治疗中,医生为患者进行耳后皮肤活检,并从耳内脂肪组织中提取出干细胞。他们称,将增殖的脂肪干细胞通过静脉注射回患者体内,能够修复患者的受损组织——在这一病例中,主要是修复因动脉硬化症而失去弹性的血管壁。
诊所墙上张贴的两张海报主要介绍了一些令人满意的治疗效果。这些成果不仅发表在顶尖的科学期刊上,还获得了一些大型制药公司的支持。这家诊所虽然是合法经营的,却无法提供治疗相关的数据。当一名未说明记者身份的来访者表示想要询问更多细节时,导医称无法证实诊所的治疗一定有效,因为治疗效果因人而异。不过,她最终解释说,这种治疗起到的更多是预防作用,是一种抗衰老治疗。
随后,《自然》(Nature)杂志联系到了该公司,想要了解一些相关问题,但一名公司负责人拒绝提供任何关于治疗效果和治疗人数的信息,并表示治疗效果会在公司之后的发布会上公布。他认为Helene诊所按照法律程序接受了所有必要的审查并获得了许可,而且没有患者出现不良反应。
类似出售细胞疗法(其有效性尚未证实)的诊所在全球范围内变得普遍起来,从墨西哥到乌克兰,从印度到澳大利亚,监管机构正努力跟上这一趋势。在美国,干细胞诊所数量激增,这些治疗没有根据,甚至在某些情况下会对患者身体产生副作用,相关机构已经在努力应对这一局面。然而,日本的情况却截然不同:由于日本政府推出两项监管法案,旨在刺激日本商业发展,促使日本成为再生医学的世界领导者,干细胞诊所得到了日本政府高层的批准和推广。
法案通过五年后,日本国内有数百家诊所提供了包括干细胞治疗在内的3700多种疗法,一批外国企业来到日本开设干细胞诊所。美国生物科技公司Athersys的首席执行官吉尔·范·伯克伦(Gil Van Bokkelen)表示,日本已经成为创新疗法发展的焦点。该公司总部位于俄亥俄州克利夫兰,目前致力于在日本推广干细胞疗法的临床实验,用于治疗中风以及呼吸系统疾病。
然而,许多公司正试图利用这些监管途径,规避严苛的测试,将这些疗法快速推向市场。科学家指出,患者可能得不到有效的治疗。大多数经许可用于治疗严重疾病的疗法缺乏科学依据,目前至少已出现4起不良反应报告,导致1人死亡。甚至,一些支持法案的政府研究人员和科学家也表示,需要对再生医学监管政策进行改革。
各个诊所都坚称自己是在法律允许的范围内开展业务。而政府官员则认为,日本的医疗体系相比于其他国家更加安全,因为政府对诊所提供的疗法都保持着密切监管。然而这些政策可能会误导人们高估这些治疗的效果。
同时,日本放宽监管的大胆尝试正在影响其他一些国家和地区。例如,台湾和印度开始效仿日本,监管机构感受到来自企业、患者和其他细胞疗法支持者施加的压力:要求加快审批进程。美国食品和药物管理局(FDA)生物制剂评估和研究中心主任彼得·马克斯(Peter Marks)指出,如果全球各地对同一领域的监管标准大相径庭,就会引发十分严重的问题。”
作为日本京都大学心脏病学家,吉木唯(Yoshiki Yui)强烈批评对再生医学放宽监管这一行为。他认为这种行为虽然促进了日本商业快速发展,但是却缺乏远见,因为支持者从未考虑过监管会出现什么问题。
安全和疗效问题
2012年12月,日本首相安倍晋三(Shinzo Abe)在上任后不久就承诺,未来十年内将投入1100亿日元(约合10亿美元)发展再生医学。就在几个月前,京都大学的山中伸弥(Shinya Yamanaka)因诱导性多能干细胞的研究成果获得了诺贝尔生理学或医学奖。安倍夸赞日本是世界再生医学研究的领导者,同时对临床应用的缓慢进展表示遗憾。他迅速出台了两项法案(参见“两项法案放宽监管”),希望改变这一情况。
两项法案放宽监管
2014年,日本出台的两项法案为细胞疗法和其他类型的再生医学进入市场提供了一条快速通道。其中,《再生医学安全法案》(Act on The Safety of Regenerative Medicine)根据风险程度将再生医学疗法分为三种类型,企业可以选择其一为自己提供的疗法登记注册。
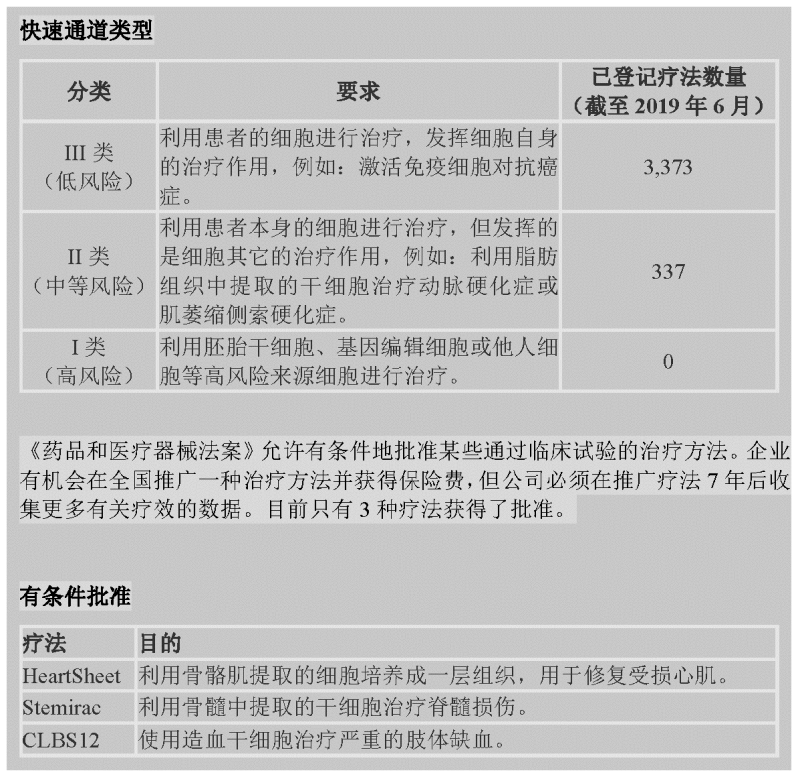
其中一项法案是2014年11月通过的《再生医学安全法案》(Act on the Safety of Regenerative Medicine),简称ASRM。该法案允许医院和诊所销售细胞疗法,且无需通过常规试验来证明药物的有效性。医院要提供这些治疗,就需要提供由日本卫生劳动福利部认证的细胞处理设备,并且这些疗法也需要由一家由卫生劳动福利部认证的独立审查机构审核通过。
在立法改革之前,无良诊所如雨后春笋般涌现,并且利用医疗旅游行业牟利。作为一名眼科医生和日本再生医学协会(Japanese Society for Regenerative Medicine)的知名成员,昌代高桥(Masayo Takahashi)一直在日本政府再生医学顾问小组工作。她表示,该法案的目的是确保所有诊所都完成注册,从而将这些诊所囊括在掌控范围内,也就是先让所有人都参与进来,然后再通过逐步严格筛选,将其中的一些疗法和诊所保留下来。
然而,批评人士指出,《再生医学安全法案》提到的“注册登记”具有一定的误导性。日本神户日本理化学研究所(RIKEN)的道格·西普(Doug Sipp)研究的是监管政策,他提到,注册登记让“整个行业更加透明化”,因为这迫使无良诊所必须要达到一些基本要求。然而,真正的危险是,患者会将“注册”视为“一种检验”。
例如,位于东京的时尚诊所Avenue Cell看起来更像一家水疗中心,而不是医疗中心,诊所网站上赫然宣称自己已根据ASRM的要求登记注册了相关疗法。至少有10名患者接受了治疗,将脂肪干细胞注入血液,用于治疗肌萎缩侧索硬化症(ALS)或减缓病情发展。
一名未透露记者身份的来电者向Avenue Cell诊所的客服代表询问相关信息,得到的答复是:50-70%的患者在接受治疗后病情有所缓解,每次注射的治疗费用为150万日元,而如果能够负担这个价格,最好保持每两、三个月注射一次干细胞。据称,每年约有1,000名患者在该诊所接受其它的一些治疗。
5名研究肌萎缩侧索硬化症的再生医学科学家在接受采访时表示,尚未有令人信服的证据能够证明这种干细胞治疗的效果,甚至还有一些反例。罗伯特·巴洛(Robert Baloh)在美国加利福尼亚州的席德-西奈再生医学研究所(Cedars-Sinai Medicine Institute)研究肌萎缩侧索硬化症(ALS)。他坦言,几百年来,江湖医术和错误的治疗都直接推销给了患者,这次的细胞疗法也不例外。Avenue Cell诊所的一名负责人拒绝了《自然》杂志正式采访的请求,却在邮件中声称该诊所的业务符合ASRM的标准。当询问者要求这位负责人对肌萎缩侧索硬化症专家的言论做出回应时,得到的答复是:他们忙于接诊,无暇回应。
除了证据和疗效方面的问题,批准疗法注册的委员会资历和独立性也同样令人担忧。日本厚生劳动省(负责医疗卫生和社会保障的主要部门)要求委员会应由5至8人组成,其中包括一些细胞生物学、再生医学、临床研究和细胞培养方面的专家。除此之外,律师、生物伦理学家以及生物统计学家也需要参与其中。然而,有关委员会利益冲突的相关规定并不严格。
例如,Helene诊所内部的一个审查委员会批准了包括干细胞治疗动脉硬化症在内的一系列疗法。该公司负责人表示,诊所从未给任何病人使用过这种疗法,而且疗法的注册登记是通过一个独立的第三方委员会。而厚生劳动省指出,Helene诊所的内部委员会已经于今年3月解散。Avenue Cell诊所提供的ALS疗法以及其它一些疗法已经通过了包括一名职业医师在内的审查委员会批准。Avenue Cell诊所对此并没有回应。
厚生劳动省于4月制定了一些政策,防止委员会之间的利益冲突。然而,诊所即使有完全独立的委员会,也可以找到一些委员会给自己帮腔。佐藤洋次(Yoji Sato)是日本国立卫生科学研究所(National Institute of Health Sciences)细胞疗法部门的负责人。作为两个委员会的成员,他表示委员会的资质是一个大问题。
政府正在考虑采取其他措施,例如按要求培训,完善委员会体系。佐藤说:“委员会之间可能存在利益冲突,治疗方法也可能没有效果,但这就是我们目前所面临的局限。”
尽管如此,佐藤还是认为日本的再生医学体系要优于美国的,因为美国的监管机构一直在追查一些无良诊所。他列举了两个案例——美国佛罗里达州的两名患者接受了有效性尚未证实和未经批准的干细胞治疗后失明。为了让该公司停止提供这种治疗,FDA打了4年的官司。而在日本,警察可以直接逮捕那些没有获得委员会批准的执业者。
条件性批准
安倍政府在2014年实施的另一项重要政策是《药品和医疗器械法案》(Pharmaceutical and Medical Devices Act)。根据这项法案,一家公司可以获得“条件性批准”,在全国范围内出售疗法(不仅限于单个诊所或医院),并且相应的费用会由医疗保险系统承担。与ASRM的要求不同,企业需要提供关于疗效的小规模临床试验数据,然后就可以在之后的7年内出售这种治疗方法,不过在此期间内企业还需要收集能证明治疗有效性的证据。截至目前,只有三种疗法获得了条件性批准:一种用于治疗脊髓损伤,一种用于治疗心脏病,另一种用于治疗重症肢体缺血(四肢供血不足并伴有疼痛感)。
然而,条件性批准所需的临床试验是经过简化的,这种现象引起了科学界的关注。国际干细胞研究协会(International Society for Stem Cell Research)2016年的一份报告指出,根据小规模临床试验来批准上市,可能会放宽对疗法的严格评估,并且使得“人们对该领域科学标准丧失信心”。
据称,一些患者出现了不良反应。一名为保护个人隐私而不愿透露姓名的男子患有慢性心脏病,他尝试了一种名为HeartSheet的实验性疗法。这种治疗方法主要是从患者大腿种提取出移植肌细胞,培养成薄薄的组织,并再开胸手术时移植到受损的心脏上。HeartSheet疗法于2015年被有条件地批准用于治疗缺血性心肌病。而该男子罹患的是不同类型的心肌病,但他遇到疗法创始人——日本大阪大学(Osaka University)的外科医生吉木泽(Yoshiki Sawa),并且被告知自己是这种实验性疗法的最佳人选。
该男子对此表示担心,因为几乎没有他这种类型的心肌病人接受过HeartSheet疗法,并且他自己从前也没有接受过任何心脏手术。不过,他决定尝试一下。
该男子称他的病症从未得到缓解。9个月后,他突然感到呼吸困难,这是之前从未出现过的症状。他被诊断为心力衰竭,住了一个月的院。出院一个月后,他再次住院。
在接受肌细胞移植术一年多后,他被告知需要进行心脏移植。医生告诉他,目前病情正在恶化。
然而,没有更多的信息,也无法判断HeartSheet疗法是否是导致该男子心力衰竭的直接原因。这仅仅是一个病例,心力衰竭的原因还有其他的可能。但这种可能性也反映了一部分问题。HeartSheet疗法只经过7人次的临床试验就获得了条件性批准进入市场。并且,人们对不良反应事件发生的概率和类型知之甚少。销售该疗法的Terumo公司仍然在收集有关HeartSheet对治疗缺血性心肌病有效性的数据,公司表示该男子并未接受在治疗中HeartSheet疗法。
日本政策的主要争论焦点在于随机、安慰剂对照试验是否具有参考价值。这类试验方法通常被视为传统临床研究的黄金标准,但日本政府听从了日本再生医学学会于2012年提出的一个观点,认为那些证明疗效的试验设计不应总是要求对照组服用安慰剂或是采用常规疗法。
在HeartSheet疗法的临床试验中,吉木泽表示,在自然情况下,这类病人的病情一般会逐步恶化。在接受试验的7人中,有5人的病情没有继续恶化,就表明该疗法可能起到了一定的作用。然而,另一项有关日本3,500名患者的研究表明,大多数与吉木泽试验中被试的心脏病严重程度相似的患者,在没有接受积极干预治疗的情况下,病情也有所好转并且趋于稳定。吉木泽并未针对此事做出回应。
日本厚生劳动省一再坚持,再生医学临床试验必须设置安慰剂对照组。今年5月上市的一种名为STR01的脊髓损伤疗法遭到诟病,厚生劳动省代表宫本伸二(Shinji Miyamoto)表示,要对这种疗法进行双盲实验“在设计上是不可能实现的”,而且虚假治疗和服用安慰剂“会引发一系列伦理问题”。
长久以来,生物伦理学家一直在争论着临床实验中虚假治疗的潜在危害,以及它们对参与者是否公平。加拿大蒙特利尔麦吉尔大学(McGill University)的生物伦理学家乔纳森·金梅尔曼(Jonathan Kimmelman)对日本政府的临床试验政策提出了一些意见,因为其中的一些无效治疗会对患者造成伤害。而研究脊髓损伤干细胞疗法的医生表示,安慰剂对照试验要相对容易些。
日本札幌医科大学(Sapporo Medical University)的神经外科医生Osamu Honmou发明了STR01疗法。此前,他曾主张进行双盲、安慰剂对照试验,来证明STR01对中风患者的疗效。根据2016年的一份报告,他目前应该还在进行此项试验。不过,当《自然》杂志询问道,为什么将STR01疗法用于治疗中风造成的损伤需要临床试验,而用于治疗脊髓损伤却无需临床试验,他并未对此作出回应。而厚生劳动省的一位官员表示,虚假治疗对于治疗脊髓损伤是不符合伦理的,因为病人需要在一定的时间内接受治疗,否则之后的治疗效果会降低。然而,这样的说法也无法证明STR01疗法就是有效的。
几位日本著名的科学家告诉《自然》杂志STR01疗法也被称为Stemirac疗法,但这种疗法不应被批准用于治疗脊髓损伤。一位不愿意透露姓名的心脏病学家表示,安倍政府迫切地需要一些科研领域的成就。“安倍内阁太过激进了。”而安倍政府并未回应《自然》杂志记者的置评请求。
日本的全球野心
尽管医疗体系存在漏洞,但日本正在试图使其他国家和地区接受自己的再生医学政策,其中部分原因是为了确保能够保证这些疗法的市场占有率。根据厚生劳动省药品监管部门今年3月发布的一项5年计划,日本政府资助了一项外展计划,旨在“传播日本再生医学产品的监管模式,提高日本监管机构的信任值,并且将日本的监管模式引入其它国家。”
佐藤说,这些举措似乎产生了一些影响。台湾已经根据日本的法规起草了再生医学的条件性批准法律,韩国也于今年8月批准了一个类似于日本的审查体系。印度在2015年首次批准再生医学的审议中提到了日本的再生医学体系。今年,中国大陆出台了一项政策草案,允许医院自由地将干细胞用作“医疗实践”。西普说,其它的一些国家都做出了类似回应,它们优先考虑的是各自的经济竞争力,而不是患者的利益。
一些人希望英国也能拥有类似的体系,并且认为英国脱欧的时机是正确的。2012年2月,Celixir公司的联合创始人兼首席执行官阿詹·雷金纳德(Ajan Reginald)在接受英国广播公司(BBC)采访时表示,该公司研发了一种名为Heartcel的细胞疗法用于治疗心脏病,而脱欧可以为英国引入自己的快速监管渠道提供一个机会。
英国利物浦大学(University of Liverpool)的干细胞生物学家帕特丽夏·默里(Patricia Murray)指出,在英国,一些人十分热衷于采用日本的模式。日本放宽对再生医学监管的这种做法“使得企业能够向患者出售虚假的疗法”。
这种快节奏的发展也给其它国家和地区的监管机构带来了挑战。包括加州再生医学研究所(California Institute for Regenerative Medicine)和哈特兰研究所(The Heartland Institute)在内的企业和患者群体不断施压,要求FDA采取类似于日本的监管措施。
马克斯表示,这会造成一个问题,因为人们会拿日本来做比较,质疑为什么FDA就不能通过这样的法案。今年5月,马克斯在马里兰州巴尔的摩的医学新闻发布会上回答了记者提出的问题。他肯定地说,他的医疗研究小组也希望看到有新的疗法,但他们希望看到的是安全且有效的疗法。
RepliCel是加拿大温哥华的一家再生药物公司。2016年,RepliCel将自己的皮肤修护产品授权给了总部位于东京的化妆品公司资生堂(Shiseido)进行销售。公司首席执行官(Lee Buckler)认为,这种压力是有积极作用的。因为人们看到日本拥有这样快速的渠道获得疗法,也会不断敦促自己的国家采取相似的监管模式。
日本在干细胞生物学和再生医学方面取得的成就令人自豪,这对促进行业发展发挥了重要的作用。然而,作为诱导性干细胞的创始人,山中伸弥在放宽再生医学监管方面则选择保持相对沉默。
山中伸弥的研究所虽然致力于将干细胞疗法引入临床,但相比于日本国内其它地区快速应用再生医学的趋势,研究所似乎并不愿意仓促地进行临床试验。山中伸弥对《自然》杂志的采访者说,应该尽可能考虑采用双盲控制临床试验。尽管他知道这种方式要应用于某些细胞疗法是比较困难的,但即使在这种情况下,“科学家还是应该尽最大的努力,尽可能保证临床试验的客观性和科学性”。
一些干细胞研究人员表示,在缺乏客观和科学衡量标准的情况下,很难知道应该信任谁。昌代高桥表示,问题在于法律都是为善良的人制定的,对于很多不良善的人是无效的。尽管如此,她还是从长远角度考虑了这个问题并表示,细胞疗法在十年内将会变得十分完善,因此我们现在才能够放宽相应的监管。
作者:David Cyranoski,《自然》杂志亚太地区记者
翻译:林溪滢
审校:马晓彤
引进来源:科学美国人

本文来自:环球科学
特别声明:本文转载仅仅是出于科普传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或其它相关事宜,请与我们接洽。
[责任编辑:环球科学]


















 京公网安备11010502039775号
京公网安备11010502039775号





