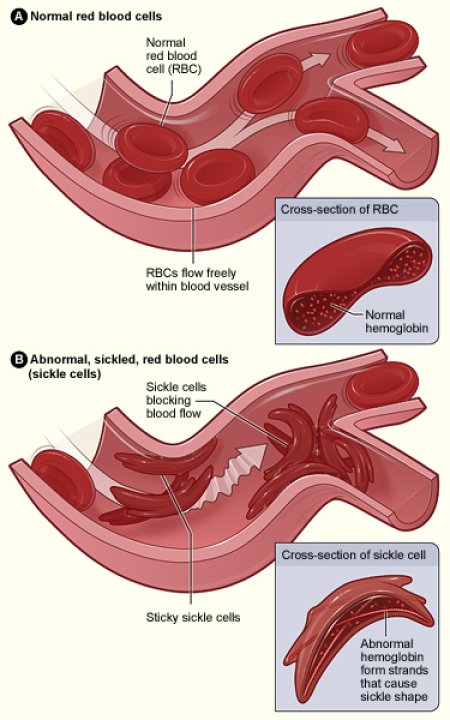
正常红细胞和镰状红细胞对比(图片来源:wikipedia)
从有记忆起,Razel Colón就记得那种疼痛。痛感沿着他的颈部和背部撕裂开,向下穿过他的双腿,最终抵达他的双脚,这些痛苦经常让他身体扭曲,无法行动。他偶尔会遭受“急性胸痛”的袭击,即突发性的呼吸困难。Colón告诉我:“那种感觉就像一头大象坐在我的胸口上,伴随着剧烈的疼痛”。去急诊室和医院看病更是家常便饭。他说:“如果幸运的话,我可以在外面呆一个月”。
这位来自新泽西州霍博肯的Colón只有19岁,但对他造成这些影响的,不受欢迎的镰刀型细胞疾病,却一直陪伴着他。但如今,他从一个已经一年半没有经历过这些痛苦的人的视角,讲述着这些故事。他能做到以前不可能做的事情:打篮球、举重、在冷水中游泳。他的长期医生,来自哈肯萨克大学医疗中心的小儿血液肿瘤学家Stacey Rifkin-Zenenberg说,他的治疗“使他从这种疾病的患者变成了携带者”。
Colón的案例代表了新兴技术曲线上的一个关键点,它可能永远改变我们治疗镰状细胞病等疾病的方法。那个世界,也就是创新基因组疗法的前沿世界,再次处于爆炸性的变化之中,而设计者DNA就处在这场对话的核心。
这是一个大胆的全新领域。其中的一些策略,如基因治疗,已经应用了一段时间,包括对细胞进行基因改造以产生疗效—也就是说,人们通过在基因组中加入修正基因,来尝试治疗疾病。传统上,病毒被用来将健康的基因送入细胞,但过去十年,人们见证了深刻变化的发生。多种基因疗法已被批准用于治疗各种疾病:鳞状细胞皮肤癌、一种罕见的遗传性失明、黑色素瘤、血液疾病等。
正是这种类型的治疗,作为蓝鸟生物公司所主导的,最大的慢病毒属持续性基因治疗试验的一部分,有效地阻止了Colón的镰状细胞病情。据公司发言人称,未公布的中期实验数据来自19名试验参与者,实验时间不少于6个月,他们都曾有严重的血管闭塞事件(VOEs)或类似Colón的镰状细胞病危机。数据显示,所有患者的严重VOEs都被完全治愈。该发言人称,该项试验正在进行中,数据尚未完成,因此必须谨慎行事,但“前景是巨大的”。
下一代技术,基因编辑,则完全是另一个层次。基因编辑使科学家能够精确地定位许多生物体(包括细菌、植物和动物)的异常基因,将该DNA剪断,然后在切口处删除、替换或添加新的DNA。“想象一下,你有一辆爆胎的汽车”,加州大学伯克利分校和创新基因组学研究所的基因编辑专家Fyodor Urnov说,“基因治疗就像是用第五个轮子,把它放在汽车的某个地方,希望汽车能再跑起来。基因编辑就是修复瘪胎的过程。”
2012年,随着一种名为CRISPR的基因编辑工具的到来,基因编辑技术得到了巨大的推动。CRISPR是“规律间隔成簇短回文重复序列”(Clustered Regularly Interspaced Short Palindromic Repeats)的英文首字母缩写。与旧的基因组编辑方法相比,CRISPR技术更容易使用、更便宜、更有效,使科学家能够快速改变DNA序列,以调控基因的功能。这可能对生物体的健康产生积极影响,甚至逆转病症。
“它经常被描述为‘分子剪刀’,”CRISPR技术的共同发明人,诺贝尔化学奖得主Jennifer Doudna说,“利用CRISPR技术,科学家们不仅可以切割任意生物体DNA的特定位置,而且还可以提供一个模板来修复DNA”。
在镰状细胞病(SCD)中,β-血红蛋白基因的单点突变导致红细胞变成月牙形,或镰刀状。这些镰状细胞具有粘性,它们会堵塞动脉,阻止足够的氧气输送到身体的各个组织。这可能导致急性、衰弱性疼痛的反复发作,正如Colón所经历的那样,并可能导致很多并发症:贫血、中风和涉及肺、心脏、肾脏、脾脏等器官的损伤。
由于反复住院和输血,这些病人的生活质量往往很差,并面临着早亡的可能。在非洲和中东这样医疗资源更为有限的地区,许多儿童在出生后的前五年,就死于SCD。
CRISPR正在加快人类通过基因工程治疗此类疾病的步伐。基因编辑的先驱、CRISPR治疗公司创始人、斯坦福大学医学院儿科教授Matthew Porteus说,研究人员目前采用两种主要的基因编辑策略尝试治愈镰状细胞患者。一种是利用CRISPR技术从根本上打开基因组的开关,重启健康胎儿血红蛋白的生产,这种蛋白的生产在生命早期被关闭了。这种策略的好处是,胎儿血红蛋白不会呈现镰刀状。
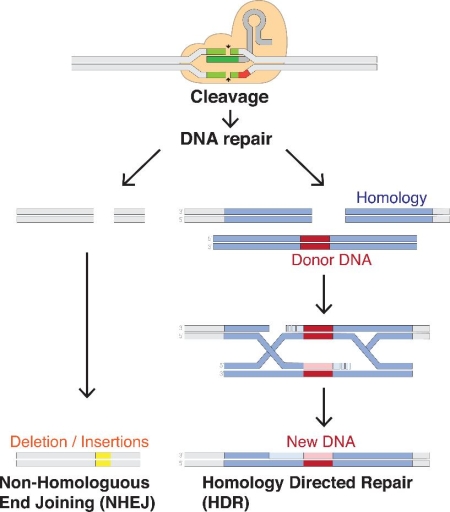
基因编辑技术进行DNA修复(图片来源:wikipedia)
第二种基因编辑策略,即基因校正,可以直接对导致疾病的错误基因突变进行修复。以镰状细胞为例,基因校正可以简单地让身体产生正常血红蛋白。为了达到这一点,研究人员已经进行了大量的工作。
虽然随着几种新药的批准,SCD的症状的缓解取得了进展,但这些药物并不是治愈性的。骨髓(干细胞)移植是治愈的唯一选择,但想要找到健康且匹配的捐赠者是很困难的。进入基因组疗法时代,加州大学圣地亚哥分校的Theodore Friedmann于1972年首次提出用其治疗遗传疾病,同年,随着斯坦福大学的Paul Berg生产出了重组DNA,基因组疗法又向现实迈进了一步。在20世纪80年代,科学家们展示了如何将DNA送入细胞,到2003年,整个人类基因组已经被破译。
这沿路上也有一些挫折,即便基因编辑系统随着新世纪的到来而出现,使用它们仍然是耗时且富有挑战性的。然后,CRISPR技术出现了,它披荆斩棘,开拓出了通向临床领域的道路,想要改变的不仅是疾病的治疗,还有疾病的预防。研究癌症、淋巴瘤、艾滋病、囊性纤维化等疾病的科学家们,已经将该技术用于包括SARS-CoV-2检测在内的诊断,甚至还用于农业方面,以制造更大的西红柿、不会发霉的苹果和可以更长久储存的蘑菇。
目前,基因编辑将为一种很常见的衰弱性遗传病—镰状细胞病提供治疗。与我交谈的几位专家首次提出,治愈SCD的方法可能即将到来。
这是一个令人震惊的想法。在实践中,切除不工作的基因,并用正常工作的基因取代它们,这种能力可能有助于减弱许多疾病的最坏影响。当2020年的诺贝尔化学奖因这项技术的发明而颁发给Jennifer Doudna和Emmanuelle Charpentier时,瑞典皇家科学院秘书长Goran K.Hansson清楚地说到:“今年的奖项有关对生命密码的改写。”
科学家们已经在研究更加精确的下一代CRISPR技术。“碱基编辑”可以在不切断DNA双螺旋结构的情况下纠正单个字母的DNA突变,最近被证明可以治疗小鼠的镰状细胞疾病。还有“先导编辑”,可以替换更大的DNA缺陷。
这一切都很了不起,并且为时尚早。Urnov说:“用基因组疗法治疗血红蛋白病,该领域并不是一个零和游戏。我相信,最终将有多种药物获得批准。将会有多种基因疗法获得批准,也会有多种基因编辑技术获得批准”。
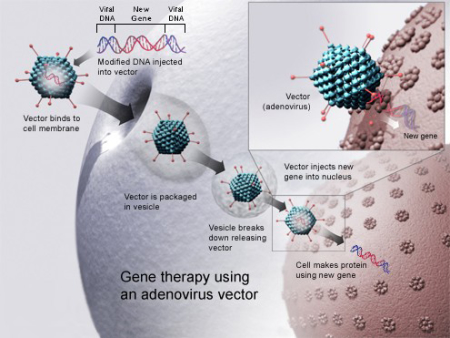
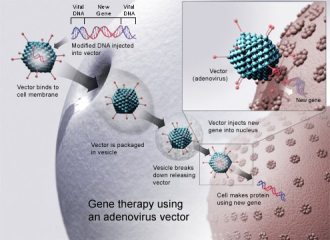
用病毒载体进行基因治疗(图片来源:wikipedia)
但是,仍有许多问题有待思考,包括像基因编辑这样的概念将会产生多远的道德影响,以及成本、安全性和可及性等问题(专家表示目前的治疗方法可能达到200万美元)。Doudna说:“真正的治愈意味着每个需要它的人都能得到治疗,这就是为什么我们正在努力研究下一代疗法,为了降低成本,让它更容易被获得。”此外,由于基因编辑并不完美,“所有基因修正疗法的长期安全性都需要进一步详细研究”,Porteus说。
在未来几个月里,加利福尼亚大学联盟(加州大学旧金山分校、伯克利分校和洛杉矶分校)将利用创新基因组学研究所开发的非病毒传递的CRISPR技术,进行首次人类开放标签I-II期试验。科学家们希望用修正的β-珠蛋白基因取代他们有问题的β-珠蛋白基因(导致了疾病的基因),直接修复他们血液干细胞中的突变,从而减轻镰状细胞试验参与者的痛苦。
该试验的主要研究者、旧金山大学儿科教授Mark Walters说:“在健康红细胞中纠正和传播的突变越多,患者接下来就越有可能被治愈。通过基因组疗法,镰状细胞病未来将被彻底治愈”。毕竟,这是该技术的最高应用,只要我们继续了解和探索该领域,它就有可能变成现实。
撰文:Carolyn Barber,医学博士,担任急诊科医生已有25年。她是无家可归者工作项目Wheels of Change的联合创始人,也是诸多文章和新书《Runaway Medicine:What You Don't Know May Kill You》的作者,该书最近被评为亚马逊健康管理领域新书榜的榜首。
翻译:张楚
审校:郭晓
引进来源:科学美国人

本文来自:中国数字科技馆
特别声明:本文转载仅仅是出于科普传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或其它相关事宜,请与我们接洽。
[责任编辑:环球科学]
















 京公网安备11010502039775号
京公网安备11010502039775号





