故事的最后,韩春雨没能携NgAgo干掉“基因魔剪”CRISPR/Cas9
2017-08-23 10:08:002016年,韩春雨声名鹊起。
5月2日,《自然》杂志在线发表了他的基因编辑技术NgAgo。这一技术的效率之高,足以媲美已有“基因魔剪”美誉的CRISPR/Cas9,另外,NgAgo有望以一个目标序列进行基因编辑,而Cas9不仅需要目标序列,还需要另外一个附近的识别(PAM)序列。
这是一个技惊四座的亮相。
而之后,事件的走向堪称一波未平一波又起,直到8月3日,韩春雨撤稿,《自然-生物技术》也发表了题为“是该数据说话的时候了”的社论。故事似乎尘埃落定。
在这个并不happy的ending里,
曾被冠以“诺奖级成果”的NgAgo技术,仍然没有撼动CRISPR/Cas9的江湖地位。
CRISPR是何方神圣?
它是clustered regularly interspaced short palindromic repeats (成簇规律间隔短回文重复)的首字母缩写。
其实,CRISPR已有数亿年的历史了。它起初是细菌抵御病毒的一种机制。病毒这种不速之客懒得构造自己的复制系统,喜欢把它们的遗传基因片段插入到细菌的细胞内。当细菌受到病毒的感染时就会进行反击,用一段DNA片段包围住入侵的病毒DNA片段,然后将这段病毒DNA片段从自己的基因序列上切出去。
虽然细菌进化出这种聪明的反击机制的历史如此悠久,但直到最近才被人类知晓。
2012年,杜德娜和卡尔庞捷优化了CRISPR系统,使它更标准、更方便,而且证明了不仅仅是细菌,任何来源的DNA都可以进行CRISPR操作。这是一项真正的颠覆性技术。
数月之后,张锋证明CRISPR技术可以应用于人类DNA的操作。这些工作使遗传学一夜之内被改写。现在,至少在理论上,科学家可以利用这个新工具对任何基因组进行前所未有的操作:删除、添加,甚至插入几组全新的DNA片段。
现在,CRISPR已经制造出了第一种无法变褐的蘑菇,第一批由DNA增强型细胞产生的有漫画里一样强壮肌肉的狗,还有一系列正待走向市场的优质农作物。有人甚至利用CRISPR技术培育了可以抵抗疟疾和寨卡病毒的蚊子。
未来,CRISPR还能做什么?
美国宾夕法尼亚州立大学卡尔·朱恩博士正在做一项雄心勃勃的研究项目:用颇具争议的CRISPR基因编辑工具治疗18位晚期癌症患者。
朱恩说:“早期的基因修补尝试就像在黑暗中飞翔。有了CRISPR之后,我决定在人身体上尝试一下。”朱恩的实验是CRISPR技术在人体上的首次尝试,同时也是迄今为止对人体基因组进行的最大规模的基因操作。朱恩的18位实验患者将成为世界上第一批接受CRISPR编辑处理细胞的患者。在治疗中,他将对患者的细胞进行基因编辑,使它们具备抵御癌症的能力。像许多癌症患者一样,这些患者尝试了各种治疗方法,已经没有治愈的希望。在杜德娜、卡尔庞捷和张锋工作的基础上,朱恩的小组将提取患者的免疫T细胞,然后用CRISPR技术改变这些细胞的3个基因,把细胞们转化成抗击癌症的超级战士。然后,他们把这些基因编辑过的抗癌T细胞重新融合到体内,看这些细胞是否能够找到并摧毁肿瘤。
人们对此寄予了厚望。无论是否成功,这一尝试都将为如何正确改写人类基因编码提供重要信息。朱恩的研究可能会证实,CRISPR不仅对癌症,还可以对诸如镰刀型细胞贫血症、囊性纤维化等基因缺陷型疾病,以及II型糖尿病、阿尔兹海默病等慢性疾病提供革命性新疗法。
但人们对此也持有巨大争议,部分原因在于这一技术非常简单。科学家既然可以高效编辑癌细胞的基因,就可以改变发色基因、肥胖基因、数学能力基因等。伦理学家担心,如果这一技术被别有用心的人利用,后果将不堪设想。没人反对将CRISPR用于治疗晚期癌症病患,但慢性患者呢?治疗残疾呢?CRISPR可以用来治疗肥胖症吗?毕竟肥胖症也引发了大量危及生命的疾病。谁来决定CRISPR的使用界限?
这些都是后话了。既是后话,不如先按下不表,翻个篇,看看“前情提要”吧。
有技术的地方就有江湖。在基因编辑这个江湖上,有谁曾独领风骚,谁又昙花一现?而谁,会是终极霸主呢?
搬好小板凳,盘点现在开始
基因编辑的原理类似于常见的外科手术,主要由两个关键部分构成。第一是手术刀。这是一类被称作酶的蛋白质,是手术完成的关键。第二是识别装置,有蛋白质、DNA或RNA等。它们就像外科医生,指挥着手术刀,以保证纠正错误基因的同时不伤害正常基因(就像外科手术切盲肠的时候不能将大肠甚至肾脏等切除一样)。
基因打靶
手术刀:重组酶
识别装置:和待手术基因序列基本一致的DNA
基因打靶是20世纪80年代出现的一种技术,发明该技术的三位科学家因此获得2007年诺贝尔生理学或医学奖。在小鼠身上的实验已经取得成功:对胰岛素基因损伤的糖尿病小鼠进行基因打靶可治疗其糖尿病。但该技术应用于临床存在巨大难题,主要原因在于,大部分细胞内的重组酶活性都很低——手术刀不锋利难以保证手术的成功。
限制性内切酶法
手术刀:限制性内切酶
识别装置:限制性内切酶
限制性内切酶是一类特殊的手术刀。它具有识别功能,可以专一识别一段基因序列,同时将DNA切开。限制性内切酶主要存在于细菌中。经典的限制性内切酶识别序列过短(4~6个碱基),不能有效区分2万多种不同的基因,容易出现“手术误伤”。
大范围核酸酶法
手术刀:大范围核酸酶
识别装置:大范围核酸酶
大范围核酸酶能够识别多于14个碱基的序列,理论上可区别所有基因。但这类酶的数量太少,绝大多数基因都找不到相应的酶,缺了手术刀就无法进行手术。
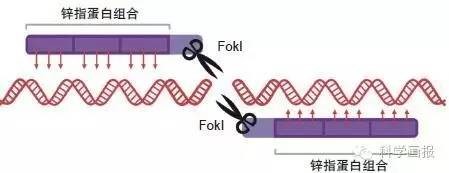
锌指核酸酶技术(ZFN)
手术刀:DNA内切酶FokI
识别装置:锌指蛋白
锌指蛋白是一类专一识别3个碱基的蛋白质,不同锌指蛋白识别的碱基也不同,因此可根据需要进行组合,从而达到区分不同基因的目的。锌指蛋白没有切开DNA的能力,工作时需要手术刀——DNA内切酶FokI(一种核酸酶)的配合。
锌指核酸酶技术(ZFN)将手术刀和识别装置分离,并利用外源的手术刀增加基因的切开效率,是一个很大进步。但是,该技术需要根据基因序列进行锌指蛋白组合,组合后的识别效率不高,容易引起手术“误伤”。
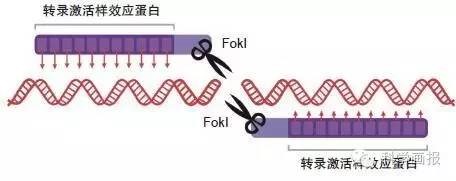
转录激活样效应蛋白核酸酶技术(TALEN)
手术刀:DNA内切酶FokI
识别装置:转录激活样效应蛋白
转录激活样效应蛋白也可专一识别碱基,且一种效应蛋白识别一种碱基。这为组合带来更大便利。如果识别18个碱基,只要根据一一对应关系组合18个效应蛋白即可,组合后的识别效率远远高于锌指蛋白,且设计过程大大简化。其效率较高,操作相对简洁,因此得到广泛应用,被评为2010年十大科学突破之一。但该技术涉及烦琐的蛋白质组合,大多数普通工作人员无法有效掌握,从而为普及带来不便。
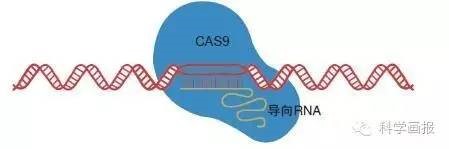
导向RNA辅助的DNA手术(CRISPR-CAS9)
手术刀:细菌核酸内切酶CAS9
识别装置:导向RNA
这是2012年初出现的新方法。将识别装置(导向RNA)和手术刀(细菌核酸内切酶CAS9)同时转移入细胞内,识别装置与待手术的目标基因实现专一配对,并启动手术刀,从而将两条DNA链同时切开。
该技术利用碱基配对原理实现识别效应,大大简化了设计程序和实验操作,有利于推广和应用。较高的基因切开效率使其成为2013年十大科学突破之一。此外,转入多个特异性导向RNA还可同时实现多基因手术,从而为科学研究和实际应用带来更大便利。