艾滋病疫苗的科学挑战和应对策略
2020-11-27 12:58:00艾滋病(acquired immunodeficiency syndrome, AIDS)由人类免疫缺陷病毒(human immunodeficiency virus, HIV)引起, 自1981年发现以来, 已造成全球6000多万人感染和3000多万人死亡, 成为人类健康最大的威胁。科学界和企业界成功研制几十种抗HIV药物, 使艾滋病从“超级癌症”变成可长期存活的慢性病。尽管不断加强防治减缓了HIV的流行, 但每年仍有200多万人感染和100多万人死亡。我国年报告HIV/AIDS病例从20世纪初的几千例增加到现在的十多万例。疫苗控制传染病最为有效, 人类战胜艾滋病需要疫苗是广泛的国际共识。HIV疫苗是医学研究的最大挑战之一, 亦是Science提出的重大科学前沿问题之一。
《科学通报》特邀中国疾病预防控制中心性病艾滋病预防控制中心邵一鸣研究员为您解读,从剖析HIV疫苗的科学挑战入手, 回顾既往HIV疫苗研究的经验教训, 介绍当今最新研究进展和发展方向, 最后对艾滋病疫苗能否成功的问题做出科学的评判。
艾滋病疫苗面临的科学挑战
HIV疫苗一直是艾滋病研究的重点, 研究人员开展了大量的基础研究和临床试验, 尚未有重大突破。诸如HIV复制太快、高度变异、攻击免疫系统、缺乏动物模型等均不是关键, 当今的技术足以解决这类挑战, 可根据流感病毒当年变异的监测数据, 及时生产出来当年所需的疫苗。HIV疫苗面对的最大挑战不是技术, 而是科学问题。
借用狄更斯的《双城记》, 将疫苗分为两类(图1), A类是针对自然感染可以诱导宿主产生保护性免疫的病原体, 研制疫苗只需找出对应的病原, 按传统工艺对之灭活或减毒, 接种人体就能达到预防该类疾病的目的。这是因为人体免疫力在进化上就强于这类病原。例如, 感染乙肝和甲肝病毒时, 多数人可清除病毒, 体内有抗体却没有病毒。少部分未清除病毒的感染者多可控制病毒成为健康携带者。而作为B类病原体的HIV感染人体时, 免疫系统既不能清除也无法长期控制病毒, 不存在有抗体没病毒的状况, 如不治疗大多会发病死亡。研究A类疾病疫苗是低枝易摘果实, 而B类病原疫苗则是难上加难, 因为自然进化的力量在病原体, 而不是我们一边。
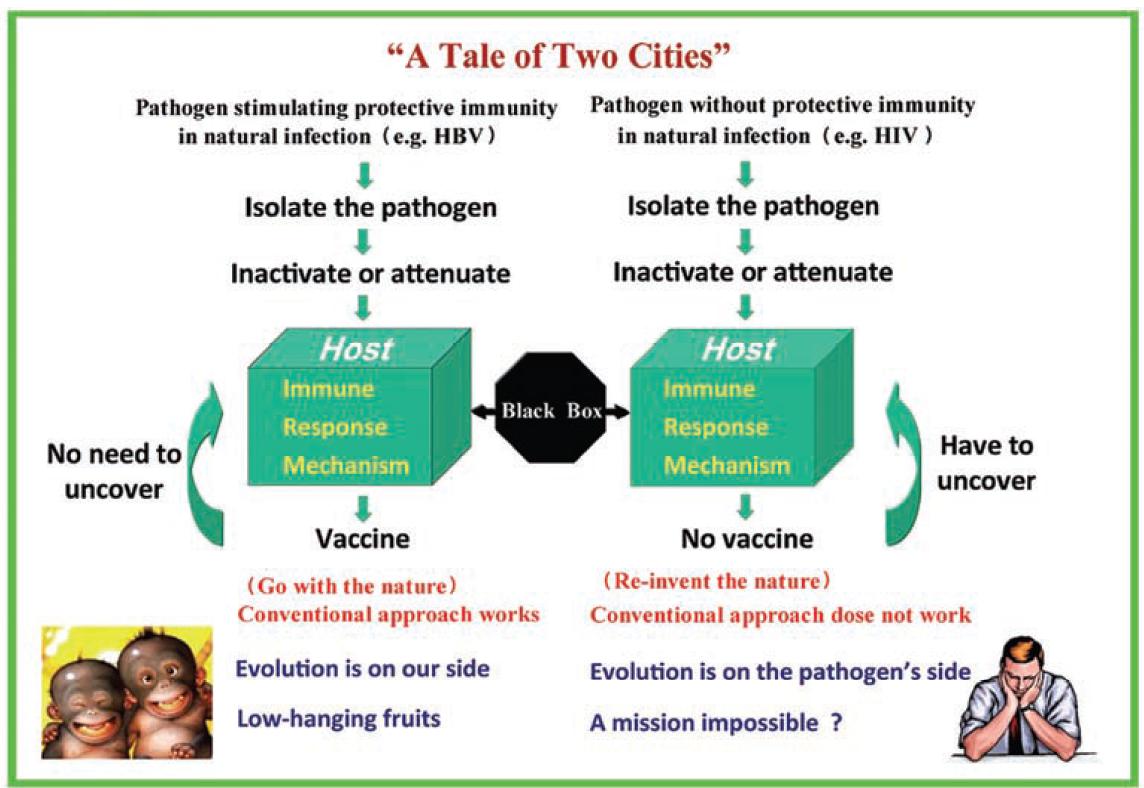
图1 与传统疫苗相比, 艾滋病疫苗面临的科学挑战
艾滋病疫苗研究的历史和经验教训
HIV疫苗除进行大量基础和临床前研究外, 还开展了数百次Ⅰ, Ⅱ期临床试验和4次Ⅱb/Ⅲ期临床试验。研发历史可粗分为对应一至三代疫苗的3个10年。
一代HIV疫苗主要研究抗体, 参照首个基因工程疫苗——默克公司乙肝膜蛋白疫苗的技术路线, 研制了HIV膜蛋白疫苗。该阶段以Vaxgen公司的gp120疫苗在Ⅲ期临床试验的失败而告终。
二代艾滋病疫苗主要研究细胞免疫, 多采用DNA疫苗和病毒载体的技术, 诱导机体产生杀伤T细胞。默克公司和美国国立卫生研究院(National Institutes of Health, NIH)疫苗研究中心(Vaccine Research Center, VRC)以非复制型5型腺病毒(Ad5)载体研制疫苗先后失败, 疫苗还增加了HIV感染的风险。
三代HIV疫苗主要研究各类疫苗的联合免疫应用, 如同艾滋病药物的鸡尾酒疗法。领跑项目是美国NIH组织Aventis Pasteur公司的痘病毒载体疫苗与Vaxgen公司gp120疫苗联合, 在泰国开展的RV144 Ⅱb期临床试验获得了31%的保护效果。疫苗的保护性与针对gp120 V1V2区的结合抗体和ADCC抗体有关。尽管疫苗因保护率低未能上市, 但首次在人体显示了效果。RV144试验使HIV疫苗主流研发路线, 完成了从抗体到细胞免疫, 再转回到抗体免疫的一个轮回。
从30年HIV疫苗研究中可汲取以下经验: 一代苗简单模仿乙肝疫苗的技术, 忽视了A, B两类病原的本质差异; 抗体疫苗首败即弃, 退守第二线阵地; 在需百家争鸣时, 将资源过早集中于细胞免疫; 追求绝对安全, 放弃了复制型载体疫苗的路线。国际HIV疫苗界不够坚持, 30年技术路线转换了3回。
HIV疫苗创新研究的新进展和新动向
近年来科学家采用大量新技术, 推动出现了一批新成果。采用系统生物学的方法来探讨疫苗免疫保护机制, 寻找新的研究方向。临床试验不仅为注册, 更多是为了概念验证, 以加快临床研发进程。突出性的进展和动向有:
1 超强广谱中和抗体的发现及应用
使用单细胞分选和二代测序等技术, 从少数HIV感染者中发现了以VRC01为代表的超强广谱中和抗体(bNAbs), VRC01能“绑定”HIV-1结合CD4受体的表位, 把既往单抗仅中和20%~30%全球流行株的中和谱提升到90%以上。 随后, 多国科学家发现了针对HIV-1膜蛋白多个表位的一系列超强bNAbs。该突破不仅开发出大量单抗新药, 极大地提升了抗体结构功能和成熟进化研究水平, 还催生了反向疫苗学研究。
因单抗药价昂贵, 以往仅用于特定的治疗。美国NIH投入上亿美元, 在非洲开始了HVTN703的Ⅱb期临床试验, 给妇女静注VRC01单体预防HIV感染。为降低费用, 其他科学家则采用携带VRC01基因的病毒载体AAV注射动物, 由体内产生的抗体对抗病毒的感染。将抗体药物和基因治疗用于长期预防, 是HIV疫苗研究的首创, 但用于现场尚需时日。因为当前每人每年数万美元的抗体药费是难以为继的, 基因治疗也面临着自身技术尚不成熟的挑战。
2 反向疫苗学研究的探索
大量超强bNAb的发现、结构解析和功能研究, 为HIV新免疫原设计另辟蹊径, 推动了反向疫苗学研究。结构生物学家设计出大量仅与特定结构的bNAb结合、有极高亲和力的新免疫原。然而, 用其免疫动物后都无法诱导出同样的中和抗体。这些实验说明, 使疫苗能与目标抗体结合的抗原性与用其诱导出同类抗体的免疫原性是完全不同的属性。因而, 当前HIV反向疫苗学研究只进展到半程。研究发现, VRC01从最初的胚系抗体到最后成熟抗体之间有高达30%的基因突变, 而其他病毒的中和抗体从胚系到成熟多只有5%左右。这说明HIV bNAb的产生是漫长的过程, 也解释了为何bNAb在HIV感染多年才出现, 而不像其他病毒在几周后就出现。
至于bNAb为何只在10%左右的感染者出现, 则另有其因。 一些学者和笔者认为, 鉴于人类基因组中丰度最高的基因之一是内源性逆转录病毒的序列, 人体免疫监视功能或许将属于逆转录病毒的HIV当作自身抗原而产生免疫耐受, 阻断了产生bNAb的B细胞发育。因而, 要诱导bNAb的产生, 还可能需要寻找打破此类免疫耐受的安全途径和措施。
3 HIV疫苗的合理设计
医学本质上是经验科学, 疫苗也是从总结临床实践的经验而来的, 无论是我国宋代的人痘天花疫苗, 还是牛痘天花疫苗都是如此。这得益于多数疫苗是上述A类病原, 借助进化力量而获成功。对B类病原体的HIV疫苗, 需要重新设计发现病毒弱点, 挖掘免疫潜能加以推进。超强bNAb的发现和反向疫苗学的兴起使之成为可能。
当前设计的重点放在诱导bNAb的产生, 主要包括两个领域。(ⅰ) 设计更稳定的三聚体gp140膜蛋白, 或使用纳米技术将其制备到病毒样颗粒表面。设计完成的新型免疫原已能诱导出针对同型病毒的中和抗体, 但其广谱性还不够强, 无法中和异源毒株。(ⅱ) 设法激活bNAb胚系抗体的B细胞, 因为现有疫苗尚做不到这一点。一些学者将已知胚系抗体的基因敲入转基因小鼠(Mus musculus), 并能经免疫接种激活相应胚系抗体的B细胞, 但尚不能引导胚系抗体完全成熟为超强bNAb。
4 复制型病毒载体HIV疫苗的兴起
近年来, 越来越多的实验室开始在HIV疫苗中使用免疫原性更强的复制型病毒载体, 包括麻疹病毒(MV)、水痘性口炎病毒(VSV)、仙台病毒(SeV)、腺病毒(Ad)和痘病毒。由于Ad5有增加HIV感染的风险, 研究者改为使用Ad4, Ad26和Ad35进行研究。目前, VSV, MV, SeV和Ad4已完成Ⅰ期临床试验。Ad26和Ad35联合免疫已进入Ⅱ期试验, 初步分析结果显示, 该疫苗的耐受性好, 能产生针对HIV的体液和细胞免疫应答。
中国疾病预防控制中心学者依托全国疾控网络筛选出HIV疫苗株CN54, 国外学者证明其有更好诱导中和抗体的能力, 为我国和其他国家HIV疫苗所用。他们与中国农业科学院合作, 按照EIAV疫苗改造HIV抗原, 进一步拓宽了诱导中和抗体的能力。他们与北京生物制品研究所合作, 以我国复制型痘苗病毒天坛株(我国消灭天花的疫苗株)为载体研制的HIV疫苗, 可保护恒河猴(Macaca mulatta)抵御SHIV病毒的攻击。在国家科技重大专项支持下, 该疫苗已顺利完成Ⅰ期和Ⅱ期临床试验, 正准备在向Ⅱb/Ⅲ期临床试验迈进。在当前关注复制型病毒载体的HIV疫苗的浪潮中, 我国暂居领先位置。
研制艾滋病疫苗的可行性和国际大规模临床试验规划
HIV属于逆转录病毒科慢病毒属, 在已发现的7种慢病毒中, 已成功研制了两个疫苗马传染性贫血病毒疫苗( EIAV)和猫艾滋病疫苗( FIV)。 EIAV疫苗是中国农业科学院科学家在1978年率先成功研制。通过农业部在马属动物大规模应用该疫苗, 我国已彻底消除了该疾病。美国科学家在2005年成功研制了第二个慢病毒疫苗FIV, 为控制该病的流行提供了重要手段。7种慢病毒中已成功研制了两种疫苗的事实说明, 慢病毒疫苗的堡垒并非不能攻克。RV144试验31%的保护效果说明, 艾滋病疫苗也是有可能成功的。
当前, 国际HIV疫苗计划推进至少3项大规模Ⅱb/Ⅲ期临床试验: (ⅰ) 在南非开展的RV144疫苗的重复试验。该项目被称为P5计划, 由美国NIH与南非卫生部合作推进, 两大跨国药企(葛兰素史克、赛诺菲巴斯德)负责生产疫苗, 盖茨基金会补足资金, 已于今夏启动; (ⅱ) 强森公司与哈佛大学合作的非复制性病毒载体Ad26/gp140的Ⅱb期临床试验, 计划2017~ 2018年启动; (ⅲ) 中国疾病预防控制中心DNA复制型痘病毒(rTV)联合Ⅱb期临床试验计划2017~2018年启动。
我国HIV疫苗学者在国家科技重大专项的支持下, 结成中国艾滋病疫苗联盟, 积极参与亚太HIV疫苗网络和全球HIV疫苗企业计划。鉴于我国疫苗使用复制型病毒载体, 与上述两项使用非复制型病毒载体疫苗具有技术互补性, 美国NIH与中国疾病预防控制中心签署了合作协议, 联合开展我国DNA/rTV疫苗与美国NIH gp140疫苗的Ⅱb/Ⅲ期临床试验。这一项目充分体现了中美两国共同应对人类面临的最大公共卫生挑战的合作精神和大国责任。上述3项计划都将于2020年前后完成Ⅱb/Ⅲ临床试验。
根据国际机构测算, 2015~2030年, 如果使用30%有效的疫苗免疫20%的人群, 可以保护550万人免于HIV感染; 如果将疫苗有效率和免疫人群分别提高50%~30%和70%~40%, 则可以分别保护1700万人和2800万人免于HIV感染。通过国际合作的不断努力, HIV疫苗研究终将为人类实现2030年终止艾滋病的目标做出应有的贡献。
邵一鸣 ,中国预防医学科学院医学博士, 现任中国疾病预防控制中心艾滋病首席专家, 中华微生物学会副理事长, 北京大学医学部兼职教授, 南开大学讲座教授, 浙江大学讲座教授。在国家艾滋病毒检测、耐药监测和分子流行病毒三大网络建设和防治政策制定中发挥核心专家作用, 在病毒变异规律研究方面多有建树, 研制的自主创新艾滋病疫苗已完成Ⅱ期临床试验。多次获得部委和国家科技奖。在国际上任联合国艾滋病规划署和世界卫生组织的技术顾问, 国际病毒命名委员会委员和美国微生物科学院院士。
文/邵一鸣
本文来自《科学通报》

















