防控脓毒症,要瞄准细菌的武器:外膜囊泡
2020-12-10 13:48:00脓毒症与OMVs
病原体感染人体会导致炎症,当炎症失控,发展为不受控制的全身炎症反应,就可能发生脓毒症。如得不到及时控制, 脓毒症可引起多脏器功能障碍,甚至导致死亡。
在引发脓毒症的感染源中,革兰氏阴性菌是最常见的一种,而外膜囊泡(OMVs)是革兰氏阴性菌攻击人体的重要武器。
在一定条件和机制下,革兰氏阴性菌的细胞外膜向外膨出,释放出直径10~300 nm的球形囊泡。这些囊泡就是OMVs。在人体内,OMVs如同细菌扔出的“手榴弹”,对多种人体细胞进行打击,进而诱导免疫失控和脓毒症的发生。
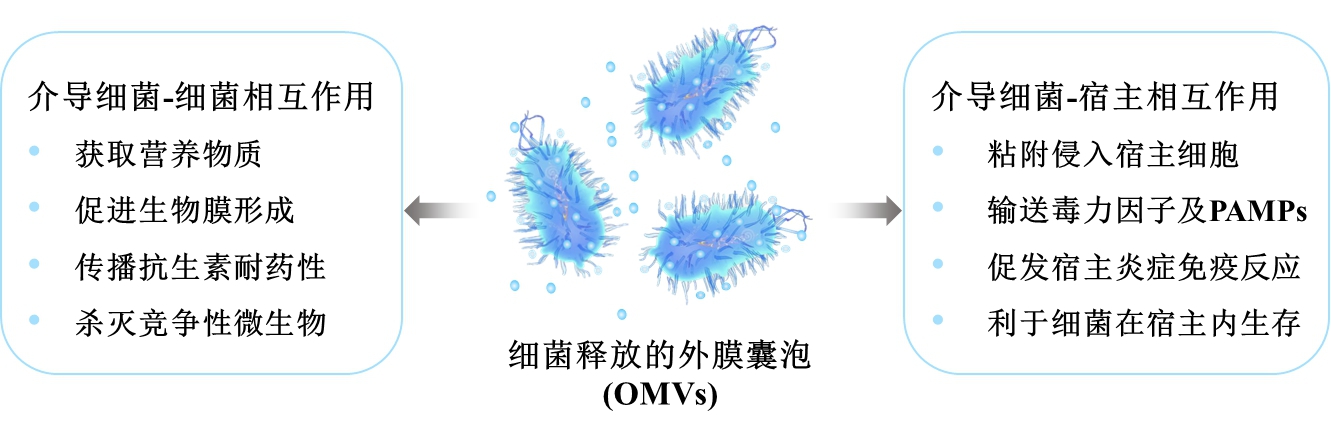
细菌OMVs的生物学功能
如上图所示,OMVs可以通过多种方式,介导“细菌-细菌”及“细菌-宿主”间的相互作用,从而提升细菌的生存及致病能力。
OMVs中富含病原体相关分子模式(PAMPs),如内毒素(LPS)、肽聚糖、细菌DNA等。进入机体后,PAMPs可与宿主细胞模式识别分子(PRRs)结合,激活免疫系统,促发炎症反应。OMVs相关的主要宿主细胞PRRs包括:由LPS激活的细胞表面Toll样受体(TLRs);由肽聚糖组分激活的胞内NOD样受体(NLRs);含半胱氨酸的天冬氨酸蛋白水解酶(Caspases),这种胞内受体可介导炎症通路的激活。
细菌感染发生后,OMVs先后与多种宿主细胞相互作用,参与脓毒症的病理进程。首先,OMVs黏附于上皮细胞,破坏上皮屏障,随后激活免疫细胞。一旦侵入血管,OMVs可进一步活化血管内皮细胞、血小板,形成炎症-凝血正反馈环路,最终引起全身炎症反应及器官功能障碍。

OMVs入侵宿主细胞、引发脓毒症的主要机制
瞄准OMVs,防治脓毒症
对OMVs致病机理的理解推动了脓毒症防治策略的发展。以OMVs及其引发的炎症反应为目标,研究者已经开发出,并正在开发更多针对脓毒症的疫苗和药物。
此外,我们也可以设计新型阳离子抗菌聚合物材料,在杀灭微生物的同时吸附和清除OMVs,从而防止局部感染进展为脓毒症等严重疾病。考虑到抗菌材料的使用也可能刺激细菌分泌OMVs,综述作者也指出,在尽可能提高OMVs 吸附清除效率的前提下,要尽可能减少对细菌OMVs生成的刺激。
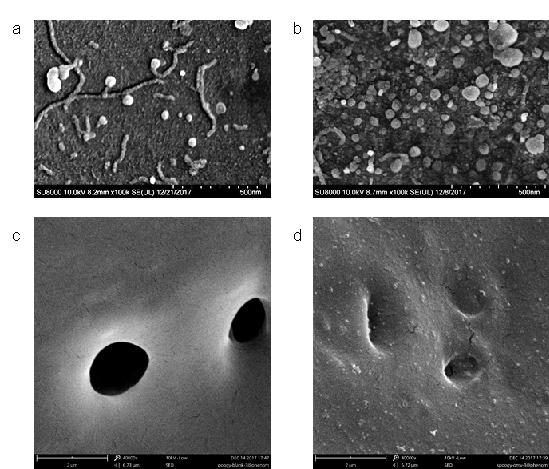
绿脓杆菌OMVs吸附于不同聚合物材料表面的扫描电子显微镜图。(a) PET膜; (b) 阳离子聚合物膜; (c), (d) 吸附OMVs前后的咪唑阳离子接枝聚氨酯海绵。其中抗菌海绵是具有LPS吸附清除功能的咪唑阳离子接枝聚氨酯Foam3 (含 6 mmol的咪唑离子二醇), 与OMVs的作用时间为4 h。
总之,脓毒症的发生是OMVs作用于宿主细胞后通过多种致病机制综合作用的结果。目前靶向OMVs的防治策略在动物模型中获得了成功,但将其应用于临床仍需克服多种障碍。随着疫苗开发、药物研发、抗菌材料等的不断进展,未来定能开发出针对OMVs的脓毒症治疗新手段,实现疾病源头的精准防控。
文/姚杰然, 丁莹莹, 袁颖慧, 刘洋洋, 诸杜明, 冒海蕾
本文来自《科学通报》

















