


精彩问答
同位素与核素有何区别?
A
首先我们要看它们的定义,同位素的定义是是某种特定化学元素之下的不同种类,同一种元素下的所有同位素都具有相同质子数目,但中子数目不同。那么这些同位素在化学元素周期表中占有同一个位置,因此得名。核素的定义是具有给定质子数Z和中子数N的一类原子核所组成的元素。
核素是基于原子核的层面上考虑问题,不仅考虑原子核中中子数与质子数的差异,同时也考虑了影响核性质的另一主要因素,即核能态的不同,对原子核的性质描述更深入,涉及核力、核结构及原子核的大小、自旋、宇称、电四极矩等。而同位素则主要关注同一元素不同原子的原子核组成、稳定性以及质量差别等方面的问题。
核素就是具有一定质子数和一定中子数的原子。也就是一个原子就是一个核素。如C-12 C-13 Cl-35 O-17等。同位素是指质子数相同中子数不同的一类原子,如:氕氘氚 Cl-35 和Cl-37 它们互为同位素。区别:同位素是一类原子,而核素只是一个原子.
核素是指具有一定数目质子和一定数目中子的一种原子。而具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。所以核素指的是原子,同位素指的是原子之间的关系。
(吴思 中国科学技术大学/王熙 北京交通大学/徐超 清华大学)
元素周期表中多少是自然中的天然元素?人工合成元素是通过什么样的手段实现的,合成出来的元素有那些?能持久存在吗?在工农业上有实际用途吗?
A
元素周期表中铀(U,92号元素)及铀之前的元素,除了锝(Tc,43号元素)、钷(Pm,61号元素)外均为天然元素。铀以后的元素,称为超铀元素(Transuranium),均为人工合成元素,会自发衰变,在自然界不能持久存在。目前人工合成元素的手段主要依靠反应堆和加速器。铀之前的元素,有些存在同位素,部分元素的特定核素也是通过人工合成的,如用于放疗的Co-60。
人工合成元素在工业、农业界、医学、生活等诸多方面有着广泛的应用。如Am-241可以用作生产烟雾报警器、Co-60可以用于癌症的放疗、C-14可以用于考古断代。有些放射性核素可以释放较强的α,β或γ射线,这些射线可以用于工业探伤、农业上放射性育种。(徐超 清华大学)
如何利用碳断定年代?
A
1947年,美国芝加哥大学化学家弗兰克·利比,首次用放射性同位素C14,准确测定了曾经有过生命的有机体的年代。我们目前使用的是14C进行年代测定,该方法由Willard Libby提出猜想并进行实验证明,他也因此项工作在1960年获得诺贝尔化学奖。
C14测年法的发明,对于考古学、海洋学和地球科学是一个巨大的贡献。放射性元素的原子不断放射射线,并逐渐转变为另一种原子,这种现象称为放射性衰变。这种衰变是有一定规律的,放射性衰变的规律以及衰变的产物都与时间这个因素有关,也就是说,它们可以被用来确定时间的变化。在古代的遗物和遗址中,随着时间的推移,有机化合物中的氢和氧是要变成水分而丢失的,只有碳这个元素是能够稳定存在的,同时含有C14这个放射性同位素。
在自然界中,碳以两种稳定的非放射性同位素形式存在:碳12(12C)和碳13(13C)和放射性同位素碳14(14C),14C的半衰期约为5730年。对于生命,动植物通过与大气或食物交换碳与周围环境保持平衡,由于大气与动植物的14C的比例是固定的,生物死后不在获得14C,14C就会随着时间减少。由此原理以及控制放射性同位素衰变的方程式:
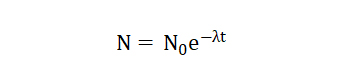
代入14C的半衰期得到:
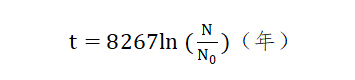
利用现代仪器可以测得14C的数量,由公式即可计算出年份。在自然界中,由于亿万年中碳14在不断的产生和衰变,最终达到了一个平衡值,可以认为碳14与碳12的比例不变。另一方面,植物通过光合作用吸收大气中的CO2,碳元素(括碳14)便进入植物体内,动物最终又以植物为生,碳14同样也分布在动物体内构成了动物的躯体,而且碳14与碳12的比例同大气中一样。当这些动物或者植物死去后,便不再和外界进行碳交换,它们体内的碳14每过5730年缩减一半,直至4万年后碳14的含量低的检测不出来。因此,从考古遗迹中的碳14与碳12的比例便可以知道遗迹的年代。
(刘强 清华大学/侯旭 厦门大学/吴思 中国科学技术大学/徐超 清华大学)
为什么有些离子团会有共用电子的情况?
A
原子团里的原子通过共用电子对,形成共价键(相当牢固),从而形成原子团。
形成原子团后,多余的电子或正电荷可以看作均匀分布在原子团上(而实际上电子对在不同原子形成原子团时会有偏向,从而一端正电,一端负电,可能是带正电的一端结合其它原子或原子团,也可能是带负电的一端)但原子团在结合形成化合物时(已形成原子团的原子)一般不会分开,(特例如NH4+形成氨气),所以不需考虑原子团中的阴、阳离子,而应整体看待。
不管是原子、原子团还是离子,只要各元素最外层电子均达到稳定结构(常见为8电子结构),就可以单独存在,例如铵根(NH4+)通过共用电子对,N最外层8电子,H有2个电子均稳定,可以单独存在。像NO3-、CO32-这些原子团,由于原子之间形成(大)π键,各个原子通过共用电子形成稳定结构,所以可以单独存在.而有些基团(也是原子团)例如-CH3,-C6H5,-NO2,-NH2等,由于其中有些原子最外层有单电子存在,没有达到稳定结构,所以不能单独存在。
(王熙 北京交通大学)
请问实际上在化学元素原子核外面真的有分层排布吗?没有的话那应该是怎么样的呢?
A
原子核外的电子层是真实存在的,但是它不能理解为原子核外面的一个薄层,它其实是按照统计电子出现概率而划分的一个区域。亨利·莫斯莱和巴克拉首次于X-射线发现了电子层。电子在原子核外排布时,要尽可能使电子的能量最低。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出,电子在原子核外排布时遵守下列次序:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d...
(侯旭 厦门大学)
京ICP备11000850号-1  京公网安备11010502039775号
信息网络传播视听节目许可证0111611号
国家科技基础条件平台
京公网安备11010502039775号
信息网络传播视听节目许可证0111611号
国家科技基础条件平台
© 2011-2022 版权所有:中国数字科技馆 未经书面许可任何人不得复制或镜像

 京公网安备11010502039775号
京公网安备11010502039775号